
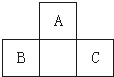
 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )| A. | Be、Na、Al | B. | B、Mg、Si | C. | C、Al、P | D. | O、P、Cl |
科目:高中化学 来源: 题型:选择题
| A. | 不同的催化剂对化学反应速率的影响均相同 | |
| B. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 | |
| C. | 新法合成能在常温下进行是因为不需要锻炼化学键 | |
| D. | 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展愿景 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 体积不变充入N2使压强增大 | B. | 体积不变充入O2使压强增大 | ||
| C. | 使体积增大到原来的2倍 | D. | 体积不变充入氦气使压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠具有醛基性质 |
| B | 加溴水,振荡,过滤除去沉淀 | 除去苯中混有的苯酚 |
| C | 向酒精和水的混合溶液中加入金属钠 | 确定酒精中混有水 |
| D | 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的水解方程式:NH4++H2O═NH3•H2O+H+ | |
| B. | NH3•H2O的电离方程式:NH3•H2O?NH4++OH- | |
| C. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- | |
| D. | HCO3-的电离方程式:HCO3-+H2O?H2CO3+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com