

·ÖĪö £Ø1£©ÓÉøų¶ØµÄ·½·ØæÉÖŖ£¬·½·Ø¶žÉś³É¹ĢĢ嶞Ńõ»ÆĀČ£¬Ć»ÓŠ¶¾ø±²śĘ·£¬“Ó·“Ó¦µÄ°²Č«ŠŌŗĶ»·±£Į½øö½Ē¶ČĄ“»Ų“š£»ÓĆĀČĖįÄĘ£ØNaClO3£©”¢ŃĒĮņĖįÄĘ£ØNa2SO3£©ŗĶĮņĖį¹²ČČÖʱø¶žŃõ»ÆĀČ£¬»¹Éś³ÉĮņĖįÄĘŗĶĖ®£»
£Ø2£©¶žŃõ»ÆĀȵķŠµćµĶ£¬BĪŖClO2µÄÄż¼Æ×°ÖĆ£¬B×°ÖĆÓ¦½µµĶĪĀ¶Č£»CĪŖĪ²ĘųĪüŹÕ×°ÖĆ£¬æÉŃ”Ōń¼īĄ“ĪüŹÕĪ²Ęų£¬·¢ÉśŃõ»Æ»¹Ō·“Ó¦£»ÓÉĪ¢¹Ū¹ż³ĢæÉÖŖ£¬ĀČĘųÓėNaClO2·“Ó¦£»
£Ø3£©øł¾ŻµČÖŹĮæµÄ¶žŃõ»ÆĀČŗĶ“ĪĀČĖįÄĘ×öŃõ»Æ¼Į¹ż³ĢÖŠ×ŖŅʵĵē×ÓµÄĮæĄ“¼ĘĖćĻū¶¾Š§ĀŹ£»ClO2Ńõ»Æ³żČ„Mn2+£¬Éś³É¶žŃõ»ÆĆĢ”¢ĀČĄė×ÓŗĶĒāĄė×Ó£®
½ā“š ½ā£ŗ£Ø1£©“Ó»·¾³”¢°²Č«ŗĶ²śĀŹ½Ē¶Čæ¼ĀĒӦєŌń·½·ØŅ»ŌŅņŹĒ·½·ØŅ»µÄȱµćÖ÷ŅŖŹĒĶ¬Ź±²śÉśĮĖ“óĮæµÄĀČĘų£¬²»½ö²śĀŹµĶ£¬¶ųĒŅ²śĘ·ÄŃŅŌ·ÖĄė£¬Ķ¬Ź±ŗÜÓŠæÉÄÜŌģ³É»·¾³ĪŪČ¾£¬»ņ·½·Ø¶žµÄÓŵćŹĒ°²Č«ŠŌŗĆ£¬Ć»ÓŠ²śÉś¶¾ø±²śĘ·£»ÓĆĀČĖįÄĘ£ØNaClO3£©”¢ŃĒĮņĖįÄĘ£ØNa2SO3£©ŗĶĮņĖį¹²ČČÖʱø¶žŃõ»ÆĀČ£¬»¹Éś³ÉĮņĖįÄĘŗĶĖ®£¬»Æѧ·“Ó¦ĪŖ2NaClO3+Na2SO3+H2SO4=2ClO2”ü+2Na2SO4+H2O£»
¹Ź“š°øĪŖ£ŗ·½·Ø¶ž£»·½·ØŅ»µÄȱµćÖ÷ŅŖŹĒĶ¬Ź±²śÉśĮĖ“óĮæµÄĀČĘų£¬²»½ö²śĀŹµĶ£¬¶ųĒŅ²śĘ·ÄŃŅŌ·ÖĄė£¬Ķ¬Ź±ŗÜÓŠæÉÄÜŌģ³É»·¾³ĪŪČ¾£»»ņ·½·Ø¶žµÄÓŵćŹĒ°²Č«ŠŌŗĆ£¬Ć»ÓŠ²śÉś¶¾ø±²śĘ·£»2NaClO3+Na2SO3+H2SO4=2ClO2”ü+2Na2SO4+H2O£»
£Ø2£©¶žŃõ»ÆĀȵķŠµćµĶ£¬BĪŖClO2µÄÄż¼Æ×°ÖĆ£¬B×°ÖĆÓ¦²¹³ä£Ø±łĖ®£©ĄäÄż×°ÖĆ£¬CĪŖĪ²ĘųĪüŹÕ×°ÖĆ£¬æÉŃ”ŌńNaOHČÜŅŗĄ“ĪüŹÕĪ²Ęų£»ÓÉĪ¢¹Ū¹ż³ĢæÉÖŖ£¬ĀČĘųÓėNaClO2·“Ó¦£¬ÓÉŌ×Ó¼°µē×ÓŹŲŗćæÉÖŖ£¬·“Ó¦ĪŖ2NaClO2+Cl2=2NaCl+2ClO2£»
¹Ź“š°øĪŖ£ŗĖ®Ō”¼ÓČČ£Ø±łĖ®£©ĄäÄż£»NaOHČÜŅŗ£»2NaClO2+Cl2=2NaCl+2ClO2£»
£Ø3£©¶žŃõ»ÆĀČ×öĻū¶¾¼ĮŹ±£¬±»»¹Ō³ÉCl-£¬ÖŹĮæŹĒmµÄ¶žŃõ»ÆĀČ×ŖŅʵē×ÓŹĒ$\frac{5m}{67.5}$mol£¬“ĪĀČĖįļ§×öĻū¶¾¼ĮŹ±£¬±»»¹Ō³ÉCl-£¬ÖŹĮæŹĒmµÄ“ĪĀČĖįÄĘ×ŖŅʵē×ÓŹĒ$\frac{2m}{74.5}$mol£¬ĖłŅŌ¶žÕßµÄĻū¶¾Š§ĀŹÖ®±ČŹĒ$\frac{5m}{67.5}$£ŗ$\frac{2m}{74.5}$=2.76£»ClO2Ńõ»Æ³żČ„Mn2+µÄĄė×Ó·½³ĢŹ½ĪŖ2ClO2+5Mn2++6H2O=MnO2”ż+2Cl-+12H+£¬
¹Ź“š°øĪŖ£ŗ2.76£»2ClO2+5Mn2++6H2O=MnO2”ż+2Cl-+12H+£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄŠŌÖŹ£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕĻ°ĢāÖŠµÄŠÅĻ¢¼°·¢ÉśµÄŃõ»Æ»¹Ō·“Ó¦”¢ÖʱøŹµŃé×°ÖƵÄ×÷ÓƵČĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬ĢāÄæÄŃ¶Č²»“ó



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼--12 Ō×Ó£ŗ612C | B£® | CŌ×Ó×īĶā²ćµē×ӵĹģµĄ±ķŹ¾Ź½£ŗ | ||
| C£® | “×ĖįÄʵķÖ×ÓŹ½£ŗC2H3O2Na | D£® | 2-¼×»ł-1-±ū“¼µÄ½į¹¹¼ņŹ½£ŗ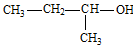 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
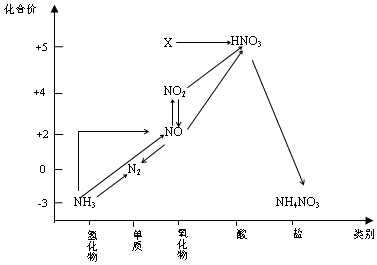
| A£® | XŹĒN2O5 | |
| B£® | æÉÓĆÅÅæÕĘų·ØŹÕ¼ÆNOĘųĢå | |
| C£® | ¹¤ŅµÉĻŅŌNH3”¢æÕĘų”¢Ė®ĪŖŌĮĻÉś²śĻõĖį | |
| D£® | ÓÉNH3”śN2£¬“ÓŌĄķÉĻæ“£¬NH3æÉÓėNO2·“Ó¦ŹµĻÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µŲ¹µÓĶ²»ŅĖŹ³ÓĆ£¬æÉ·ÖĮóĢįČ”ĘūÓĶ | |
| B£® | ¶žŃõ»Æ¹čæÉÓĆÓŚÖĘČ”¹āµ¼ĻĖĪ¬ | |
| C£® | ĪŖ·ĄÖ¹ø»Ö¬Ź³Ę·Ńõ»Æ±äÖŹ£¬ŌŚ°ü×°“üÖŠ·ÅČėÉśŹÆ»Ņ | |
| D£® | ÄĘ”¢¼Ų”¢ĢśµČ½šŹōӊѤĄöµÄŃÕÉ«£¬æÉÓĆÓŚÖĘŌģŃ껚 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | K+”¢ClO©\”¢SO42©\”¢HCO3©\Ņ»¶ØÄܹ²“ęÓŚ c£ØFe3+£©=0.1mol•L©\l µÄČÜŅŗÖŠ | |
| B£® | “ÅŠŌŃõ»ÆĢś£ØFe3O4£©ČÜÓŚĒāµāĖį£ŗFe3O4+8H+ØTFe2++2Fe3++4H2O | |
| C£® | ŌŚNaClOŗĶNaCl»ģŗĻČÜŅŗÖŠµĪČė¹żĮæSO2ĘųĢ壬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗSO2+3C1O©\+H2OØTSO42©\+C1©\+2HClO | |
| D£® | Na+”¢HCO3-”¢Br-”¢Mg2+æÉŅŌŌŚ pH=8 µÄČÜŅŗÖŠ¹²“ę |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 3.0g | B£® | 6.0g | C£® | 9.0g | D£® | 18.0g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³£ĪĀĻĀ£¬¼ÓČėĀĮ·ŪÄܹ»²śÉśĒāĘųµÄČÜŅŗÖŠĖ®µēĄėµÄc£ØH+£©Ņ»¶ØŠ”ÓŚ10-7mol•L-1 | |
| B£® | ŅŃÖŖKsp£ØAgCl£©=1.56”Į10-10£¬Ksp£ØAg2CrO4£©=9.0”Į10-12£®ŌŚŗ¬Cl-”¢CrO42-ÅضČĻąĶ¬µÄČÜŅŗÖŠµĪ¼ÓĻ”AgNO3ČÜŅŗŹ±£¬ĻČÉś³ÉAg2CrO4³Įµķ | |
| C£® | ĪĀ¶ČŅ»¶ØŹ±£¬Ēæµē½āÖŹČÜŅŗµÄµ¼µēÄÜĮ¦Ņ»¶Ø±ČČõµē½āÖŹČÜŅŗĒæ | |
| D£® | ŹµŃéŹŅÓĆŠæÖĘĒāĘų£¬ĪŖĮĖ¼Óæģ·“Ó¦ĖŁĀŹ£¬æÉĻņĻ”H2SO4ÖŠµĪ¼ÓÉŁĮæCu£ØNO3£©2ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com