
����Ŀ������Ĵ������������120�꣬������ֹ������õ���Ҫ�ķ��������У���ͭ���ϰ�װ��Ƭ����ʹ�ø����ܸ�п������п�ۣ������ʹ�ø߸����Է���Ϳ�ϣ���Ԥ��������ʴ�������з�������ȷ���ǣ� ��
A.�٢ڷ���ԭ������������������������
B.�����٢ڢ�ֻ�ܼ���������ʴ��δ����ȫ����
C.��������������ʴʱ�ĸ�����ӦʽΪ��![]()
D.����Ϳ�Ͽ��Է�ˮ�������������������ں�ˮ�����ⸯʴ����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�SO2(g)+2CO(g)![]() 2CO2(g)+S(l)+Q (Q��0)������������⣺
2CO2(g)+S(l)+Q (Q��0)������������⣺
(1)�÷�Ӧ��ƽ�ⳣ������ʽ��___��2L�����У�10�����ڣ������ܶȼ�С��8g/L����CO�ķ�Ӧ������___��
(2)���Ҫ���������Ӧ�ķ�Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��___��(ѡ����)
a����ѹ b������SO2��Ũ�� c������ d����ʱ���߲���
(3)����Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����___��(ѡ����)
A��ƽ��ǰ�����ŷ�Ӧ�Ľ��У�������ѹǿʼ�ղ���
B�����������¶Ȳ��ٱ仯ʱ����Ӧ�ﵽ��ƽ��
C��ƽ��ʱ�������������䣬�����¶ȿ�����ƽ�ⳣ��
D�������������䣬ʹ�ò�ͬ�������÷�Ӧ��ЧӦ��ͬ
���Ṥҵβ��SO2��NaOH��Һ���պ������Na2SO3�����г�����0.1mol/LNa2SO3��Һ��ʵ��ⶨ��pHԼΪ8������������⣺
(4)����Һ��c(Na+)��c(OH-)֮��Ϊ___��
����Һ��c(OH-)=c(H+)+ + ___(����Һ����������Ũ�ȱ�ʾ)��
(5)����ú������ʵ������ʵ����и���Һ�ֱ�����SO2���������������ɶൽ�ٵ�˳����___(�ñ������)
A��Na2SO3 B��Ba(NO3)2 C��Na2S D������KMnO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л����˵����ȷ���ǣ�������
A. ��֬��������ˮ��Ϊ��������͵�С���Ӻ���������
B. ���������HCOOCH3����������ͬ���칹��
C. ʯ�ʹ��ѻ�����ҪĿ������߷������IJ���
D. �۱�ϩ�Ľṹ��ʽΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ������ͼ��ʾʵ��װ�ý���ijЩ������Ʊ����������ʵ�̽����ʵ�飨ͼ�мг�װ��ʡ�ԣ���
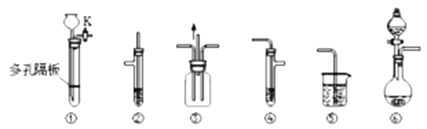
�밴Ҫ����գ�
��1��ʵ������ȡSO2����ʱ����ѡ��ĺ����Լ�___��ѡ���ţ���
a��15%��H2SO4��Һ b��75%��H2SO4��Һ c��Na2SO3���� d��CaSO3����
��Ӧ����ȡװ����___����ͼ��װ���·���ţ���
��2��ʵ��������װ�â�����ȡH2S���壬��ѡ��Ĺ��巴Ӧ����___��ѡ���ţ���
a��Na2S���� b��CuS���� c��FeS���� d��FeS2����
��Ӧ�����ӷ���ʽΪ___��
��3����μ���װ�âٵ������ԣ������������___��
��4��ʵ���������Ũ�������ˮ�ƾ���Ӧ��ȡ��ϩ���������е������⣬��ȡװ���л�ȱ�ٵIJ���������___��
��5���û�ѧ��ȤС��Ϊ̽���Ʊ���ϩ�Ƿ���ڸ�����SO2��CO2���Ʊ�������ӷ���װ�ó�����ȥ��ϩ������ѡ����װ�âڡ��ܡ��ݣ�����װ�â�ʢ�е��Լ���___��װ�â�ʢ�е��Լ���___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�Ŀ�ѧ�о��������������ʷ�����ȷ����
A.���������SO2��SiO2��NO2
B.������ʣ�CH3COOH��BaCO3��Fe��OH��3
C.��������ȼ���Ư�۾�������ϩ
D.���CaC2��ʯīϩ��HCN
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ������![]() ��
��![]() ��200 mL��Һ�м���NaOH����ʱ����Һ��
��200 mL��Һ�м���NaOH����ʱ����Һ��![]() ��
��![]() ��pH�ı仯������ͼ��ʾ�����Լ��˹���ʱ��Һ����ı仯����������������ȷ���ǣ� ��
��pH�ı仯������ͼ��ʾ�����Լ��˹���ʱ��Һ����ı仯����������������ȷ���ǣ� ��

A.![]()
B.![]() ʱ��Һ�е���������ҪΪ
ʱ��Һ�е���������ҪΪ![]() ��
��![]()
C.����![]() ���ʵ�
���ʵ�![]() ��Һ�м���CuO��
��Һ�м���CuO��![]() �ɳ�ȥ��Һ�л��е�
�ɳ�ȥ��Һ�л��е�![]()
D.������0.03 mol NaOHʱ��![]() ��
��![]() ��ȫ����
��ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ��ϵ�д���H2O��ClO-��CN-��HCO3����N2��Cl������������Ӧ�����в��ClO- ��N2�����ʵ�����ʱ��ı仯����ͼ��ʾ���й��ж���ȷ����

A.��������ClO-����ԭ������HCO3��
B.��Ӧ��ϵ�з�Ӧ�������������������
C.�������뻹ԭ�������ʵ���֮��Ϊ5��2
D.����2.24L N2����״����ʱת�Ƶ���0.5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�
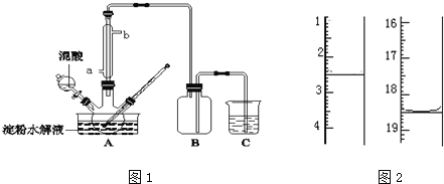
�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90��������30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺����ؽᾧ�ò��ᾧ�壬������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%���������������ǣ�_________��
��2��ʵ����������μӹ��죬�����²�������½�����ԭ����_________��
��3����������Ƿ�ˮ����ȫ���õ��Լ�Ϊ_________��
��4�������ؽᾧ�ļ�ѹ���˲����У����ձ����������⣬������ʹ�����ڹ����β��ϵ�������_________��
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��ȡ����Ʒ0.12g��������ˮ��ȫ�ܽ⣬Ȼ����0.020molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ������ʱ��Һ��ɫ�仯Ϊ_________���ζ�ǰ��ζ����е�Һ�������ͼ2��ʾ����ò��ᾧ����Ʒ�ж�ˮ�ϲ������������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĵ��ʼ��仯������������������к���Ҫ����;��
��1�����Ǻϳ����ᡢ��κ͵��ʵĻ���ԭ�ϡ���һ���������õ����������ϳɰ�����Ȼ�����ð���������ȡ���ᡣ���������������У�������������Ϊ85%��д������������ȡ����ķ�Ӧʽ____________����0.2tҺ̬������������Ũ��Ϊ40%������______________ǧ�ˡ�
��2����27.2 g Cu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡ����0.5 L������������ȫ��Ӧ������NO��Cu(NO3)2����������Һ�м���1.0 mol��L-1��NaOH��Һ1.0 L����ʱ��Һ�����ԡ�������������ȫ��������������Ϊ39.2 g��
��Cu��Cu2O�����ʵ���֮�ȣ�____________
����������ʵ���Ũ�ȣ�___________
��3����30mLNO��O2�������ͨ�����NaOH��Һ�У���ַ�Ӧ����Һ��ֻ���������ʣ�������ˮ�⣩����ʣ���������Ϊ2mL����ԭ���������NO��O2����ȣ�______________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com