
【题目】下列物质属于分子晶体的是( )
A.二氧化硅 B.碘 C.镁 D. NaCl
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2O![]() CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的是____________。
CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的是____________。
(2)向池塘水中加入一定里的CaO2·8H2O后,池塘水中浓度增加的离子有___________(填序号)。
A.Ca2+ B.H+ C.CO32- D.OH-
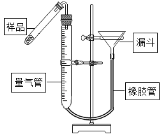
(3)CaO2在受热时能分解成CaO和O2。如图是测定样品中CaO2含量的装置。
①检查装置气密性的方法是:________________。
②加热小试管中的样品时,随着过氧化钙分解,量气瓶内的液面逐渐下降,为防止试管和量气瓶内气体压强过大,可将漏斗_______________(填“上提”或“下移”) 。
(4)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
写出O2将Mn2+氧化成MnO(O H)2的离了方程式:______________。
②取加过一定量CaO2·8H2O的池塘水样l00.00ml,按上述方注测定水中溶解氧量,消耗0.01000mol/L Na2S2O3标准溶液13.50 ml.计算该水样中的溶解氧(用mg·L-1表示), 写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室备有质量分数为98%密度为1.84g·cm﹣3的硫酸.据此下列说法正确的是( )
A.该硫酸的物质的量浓度为16.4 molL﹣1
B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 0.46 mol
C.某同学用该硫酸配制稀硫酸时,未洗涤烧杯和玻璃棒,会造成最终配制的稀硫酸浓度偏低
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表短周期的四种元素,有关它们的部分信息如下表所示:
元素 | 部分结构特点 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2等 |
Y | Y原子的次外层电子数等于最外层电子数的一半 | Y元素能形成多种单质 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答,请用相应的元素符号或化学式填写):
(1)X的元素名称是 ,X的气态氢化物的电子式是 。
(2)Z元素在周期表中的位置是第 周期,第 族。Z和W形成的化合物属于 化合物(填“离子”或“共价”)。
(3)X、Y、Z、W的原子半径从大到小的顺序是 。
(4)X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是: 。
(5)铜和X的最高价氧化物的水化物的浓溶液反应的化学方程式: 。
(6)气体分子(YX)2称为拟卤素,性质与卤素类似,请写出(YX)2与NaOH溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿是工业上制取铝的基本原料。为了除去铝土矿中少量Fe2O3和SiO2等杂质制得纯净的Al2O3,某化学兴趣小组设计探究实验,操作过程如图所示:

(1)操作过程中的试剂或方法:A是 ,B是 ,C是 。
(2)在溶液乙中通入过量CO2后发生反应的离子方程式为
(3)如果A、B互换,则通CO2应改加 。
(4)如果A、B互换,将溶液乙蒸干并灼烧,所得固体产物的主要成分是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.2:3 B. 1:5 C.1:4 D.2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是
A.二氧化硫可广泛用于食品的增白
B.硫酸钡可用作钡餐透视
C.聚乙烯塑料制品可用于食品的包装
D.次氯酸钠溶液可用于环境的消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下性质的比较中,正确的是( )
A.晶格能大小:NaI > NaBr> NaCl> NaF
B.单质的熔点:Li < Na < K < Rb
C.共价键的键能:C-C > C-Si > Si-Si
D.沸点高低:HF < HCl < HBr < HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、已知A、B、C、D、E、F、G都是中学化学常见的物质,下图中A为淡黄色固体,B、C为溶液,D、G为无色气体,E、F为白色沉淀。
①写出B→C的离子方程式
②写出D和G反应的化学方程式
③写出过量的D通入Ba(OH)2溶液中的离子方程式
II.由X、Y两种元素组成的离子化合物A。在空气中充分灼烧得到含X元素的16g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得93.2g固体。
(1)在此过程中,消耗5 mol/L的双氧水的体积至少为 。
(2)将A溶于D的稀溶液中生成E,并产生一种单质和一种气体,则该反应的化学方程式 。
(3)将化合物E隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的化学式是_____________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com