
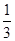 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
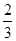 Fe(s)+ CO2(g) ¦¤HЈЅ-23.5 kJЎ¤mol-1Ј¬ёГ·ґУ¦ФЪ
Fe(s)+ CO2(g) ¦¤HЈЅ-23.5 kJЎ¤mol-1Ј¬ёГ·ґУ¦ФЪ CH3OH(g)ЎЈЗлёщѕЭНјКѕ»ШґрПВБРОКМв:
CH3OH(g)ЎЈЗлёщѕЭНјКѕ»ШґрПВБРОКМв: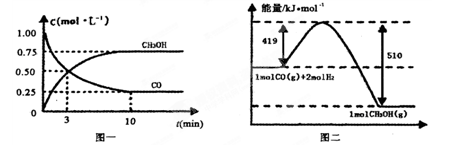
| ИЭЖч | ·ґУ¦ОпН¶ИлµДБї | ·ґУ¦ОпµД ЧЄ»ЇВК | CH3OHµДЕЁ¶И | ДЬБї±д»Ї (Q1ЎўQ2ЎўQ3ѕщґуУЪ0) |
| јЧ | 1mol COєН2mol H2 | ¦Б1 | c1 | ·ЕіцQ1kJИИБї |
| ТТ | 1mol CH3OH | ¦Б2 | c2 | ОьКХQ2kJИИБї |
| ±ы | 2mol COєН4mol H2 | ¦Б3 | c3 | ·ЕіцQ3kJИИБї |
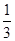 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
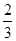 Fe(s)+ CO2(g)
Fe(s)+ CO2(g) 


| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈєІ»Пк МвРНЈєµҐСЎМв
| AЈ®Q1+Q2+Q3 | BЈ®1.5Q1-0.5Q2+0.5Q3 |
| CЈ®0.5Q1-1.5Q2+0.5Q3 | DЈ®0.5(Q1+Q2+Q3) |
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈєІ»Пк МвРНЈєМоїХМв


 Fe3Ј«(aq)Ј«3OHЈ(aq) ЎчHЈЅa kJ/mol
Fe3Ј«(aq)Ј«3OHЈ(aq) ЎчHЈЅa kJ/mol HЈ«(aq)Ј«OHЈ(aq) ЎчHЈЅb kJ/mol
HЈ«(aq)Ј«OHЈ(aq) ЎчHЈЅb kJ/molІйїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈєІ»Пк МвРНЈєМоїХМв

 CO(NH2)2(l)Ј«H2O(g)ЎЈ
CO(NH2)2(l)Ј«H2O(g)ЎЈ| AЈ®МбёЯNH3µДЕЁ¶И | BЈ®ФцґуС№Зї |
| CЈ®ј°К±ЧЄТЖЙъіЙµДДтЛШ | DЈ®К№УГёьёЯР§µДґЯ»ЇјБ |
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈєІ»Пк МвРНЈєМоїХМв
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈєІ»Пк МвРНЈєµҐСЎМв
| AЈ®Јy kJЎ¤molЈ1 | BЈ®Ј(10xЈy)kJЎ¤molЈ1 |
| CЈ®Ј(5xЈ0.5y)kJЎ¤molЈ1 | DЈ®Ј«(10xЈy)kJЎ¤molЈ1 |
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈєІ»Пк МвРНЈєМоїХМв
 C H4 (g)+2 H2O(g)Ј¬ПтТ»ИЭ»эОЄ2 LµДєгИЭГЬ±ХИЭЖчЦРідИЛТ»¶ЁБїµДCO2єНH2Ј¬ФЪ300ЎжК±·ўЙъЙПКц·ґУ¦Ј¬ґпµЅЖЅєвК±ёчОпЦКµДЕЁ¶И·Ц±рОЄCO2 0.2 molЎ¤LТ»1Ј¬H2 0.8 molЎ¤LТ»1Ј¬CH40.8 molЎ¤LТ»1Ј¬H2O1.6 molЎ¤LТ»1ЎЈФтCO2µДЖЅєвЧЄ»ЇВКОЄ________ЎЈ300 ЎжК±ЙПКц·ґУ¦µДЖЅєвіЈКэK=____________________ЎЈ200ЎжК±ёГ·ґУ¦µДЖЅєвіЈКэK=64.8Ј¬ФтёГ·ґУ¦µДЎчH_____(МоЎ°ЈѕЎЇЎЇ»тЎ°<Ў±)OЎЈ
C H4 (g)+2 H2O(g)Ј¬ПтТ»ИЭ»эОЄ2 LµДєгИЭГЬ±ХИЭЖчЦРідИЛТ»¶ЁБїµДCO2єНH2Ј¬ФЪ300ЎжК±·ўЙъЙПКц·ґУ¦Ј¬ґпµЅЖЅєвК±ёчОпЦКµДЕЁ¶И·Ц±рОЄCO2 0.2 molЎ¤LТ»1Ј¬H2 0.8 molЎ¤LТ»1Ј¬CH40.8 molЎ¤LТ»1Ј¬H2O1.6 molЎ¤LТ»1ЎЈФтCO2µДЖЅєвЧЄ»ЇВКОЄ________ЎЈ300 ЎжК±ЙПКц·ґУ¦µДЖЅєвіЈКэK=____________________ЎЈ200ЎжК±ёГ·ґУ¦µДЖЅєвіЈКэK=64.8Ј¬ФтёГ·ґУ¦µДЎчH_____(МоЎ°ЈѕЎЇЎЇ»тЎ°<Ў±)OЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈєІ»Пк МвРНЈєМоїХМв

AЈ®·ґУ¦ґ¦УЪЖЅєвЧґМ¬К±Ј¬ |
BЈ®·ґУ¦ґпµЅЖЅєвєуЈ¬ |
| CЈ®МеПµµДЧЬС№ЗїІ»±дЈ¬ЛµГч·ґУ¦ТСґпЖЅєв |
| DЈ®»мєПЖшМеµДГЬ¶И±ЈіЦІ»±дЈ¬ЛµГч·ґУ¦ТСґпЖЅєв |
 ўЩ
ўЩ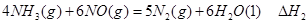 ўЪ
ўЪ ўЫ
ўЫ Ўў
Ўў Ўў
Ўў ИэХЯЦ®јд№ШПµµД±нґпКЅЈ¬
ИэХЯЦ®јд№ШПµµД±нґпКЅЈ¬ ЈЅ_________ЎЈ
ЈЅ_________ЎЈ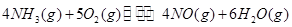
 ЈЅ
ЈЅ


| К±јд/ЕЁ¶И |   |   |   |   |
| ЖрКј | 4.0 | 5.5 | 0 | 0 |
| µЪ2min | 3.2 | a | 0.8 | 1.2 |
| µЪ4min | 2.0 | 3.0 | 2.0 | 3.0 |
| µЪ6min | 2.0 | 3.0 | 2.0 | 3.0 |
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈєІ»Пк МвРНЈєµҐСЎМв
| AЈ®Q1 +Q2 +Q3ЎЎЎЎЎЎЎЎЎЎ | BЈ®0Ј®5ЈЁQ1 +Q2 +Q3Ј© |
| CЈ®0Ј®5Q1 ЁC0Ј®5Q2 +0Ј®5Q3ЎЎЎЎЎЎ | DЈ®1Ј®5Q1 ЁC0Ј®5Q2 +0Ј®5Q 3 |
Ійїґґр°ёєНЅвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com