
| A. | 达到平衡时,两容器中反应物的转化率相同 | |
| B. | 平衡时甲容器中NH3(g)的体积分数比乙容器中的小 | |
| C. | Q1=0.2Q | |
| D. | 平衡时甲容器中气体的压强为开始时压强的3$\frac{3}{5}$ |
分析 甲、乙两个容器为等效平衡,Q1+Q2=Q,Q1=4Q2,所以Q1=0.8 Q;甲容器反应物的转化率为80%,乙容器反应物的转化率为20%,则达到平衡时,两容器中反应物的转化率不同,平衡时甲容器中NH3(g)的体积分数等于乙容器中NH3(g)的体积分数,A、B、C项错误;甲容器反应物的转化率为80%,则达到平衡时,甲容器中各物质的物质的量分别为0.2molN2、0.6molH2、1.6molNH3,根据相同条件下,压强和物质的量成正比,则P(平):P(始)=2.4:4=3:5,由此分析解答.
解答 解:甲、乙两个容器为等效平衡,Q1+Q2=Q,Q1=4Q2,所以Q1=0.8 Q;甲容器反应物的转化率为80%,乙容器反应物的转化率为20%,则达到平衡时,两容器中反应物的转化率不同,平衡时甲容器中NH3(g)的体积分数等于乙容器中NH3(g)的体积分数,A、B、C项错误;甲容器反应物的转化率为80%,则达到平衡时,甲容器中各物质的物质的量分别为0.2molN2、0.6molH2、1.6molNH3,根据相同条件下,压强和物质的量成正比,则P(平):P(始)=2.4:4=3:5,平衡时甲容器中气体的压强为开始时压强的$\frac{3}{5}$,D项正确;故选D.
点评 本题考查化学平衡的分析判断,平衡状态特征的分析应用,等效平衡的判断转化率计算是解题关键,题目难度较大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 它是一种复杂的混合物 | B. | 它由60个碳单质构成 | ||
| C. | 它是一种单质 | D. | 它是一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎把少量的浓硫酸沾在手上,应立即用大量水冲洗,然后涂上碳酸氢钠溶液 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 如果汽油、煤油等可燃物着火,应立即用水扑灭 | |
| D. | 酒精灯不慎碰翻着火,应立即用湿布盖灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.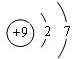 .
.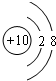 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| B. | 1 mol Cu和足量热浓硫酸反应可生成NA 个SO3分子 | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA电子 | |
| D. | 1mol铁和氯气完全反应时转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L H2O所含的水分子数目为0.5NA | |
| B. | 16g O2和O3的混合气体中所含的氧原子数目为NA | |
| C. | 1.00mol/L Na2CO3溶液中所含Na+的数目为2NA | |
| D. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,产生H2数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 两个实验均表现了NH3易溶于水 | |
| B. | 两个实验均表现了NH3易挥发 | |
| C. | 两个实验均表现了NH3是碱性气体 | |
| D. | 两个实验均表现了NH3是还原性气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个电化学过程的示意图.
如图是一个电化学过程的示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com