


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
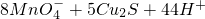 ═
═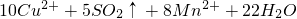
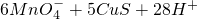 ═
═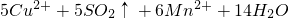
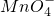 +______Fe2++______H+═______Mn2++______Fe3++______H2O
+______Fe2++______H+═______Mn2++______Fe3++______H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
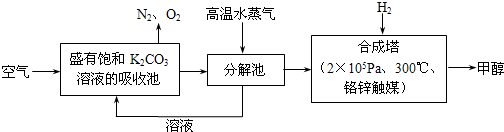
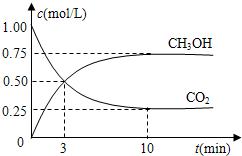
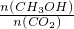 比值______(填“增大”、“减小”或“不变”).
比值______(填“增大”、“减小”或“不变”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
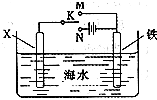 铁、铝是现代金属材料的主角.
铁、铝是现代金属材料的主角.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | O | 10 | 20 | 50 | 60 |
| S(g/lOOg水) | 2.8 | 4.3 | 6.3 | 17.0 | 22.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com