
【题目】下表给出了14种元素的电负性:
元素 | 电负性 | 元素 | 电负性 | 元素 | 电负性 |
Al | 1.5 | B | 2.0 | Be | 1.5 |
C | 2.5 | Cl | 3.0 | F | 4.0 |
Li | 1.0 | Mg | 1.2 | N | 3.0 |
Na | 0.9 | O | 3.5 | P | 2.1 |
Cl | 2.5 | S | 1.8 |
(1)同一周期中,从左到右,主族元素的电负性_________;同一主族中,从上到下,元素的电负性_________。主族元素的电负性随原子序数递增呈_________变化。
(2)短周期元素中,电负性最大的元素与电负性最小的元素形成的化合物属于____________化合物,用电子式表示该化合物:___________________。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键,则Mg3N2、BeCl2、AlCl3、SiC中为离子化合物的是_________,为共价化合物的是__________________________。
【答案】增大 减小 周期性 离子 ![]() Mg3N2 BeCl2、AlCl3、SiC
Mg3N2 BeCl2、AlCl3、SiC
【解析】
(1)由表中数据可知,第二周期元素从Li~F,随着原子序数的递增,元素的电负性逐渐增大,第三周期元素从Na~S,随着原子序数的递增,元素的电负性也逐渐增大,并呈周期性变化,同一主族中,从上到下,元素的电负性逐渐减小,故答案为:增大;减小;周期性;
(2)短周期元素中,由电负性最大的元素是F与电负性最小的元素是Na,两者形成的化合物的化学式为NaF,属于离子化合物,用电子式表示该化合物为![]() ;
;
(3)元素的电负性是元素的基本性质,且随着原子序数的递增呈周期性变化,
Mg3N2电负性差值为3.0-1.2=1.8,大于1.7形成离子键,属于离子化合物;
BeCl2电负性差值为2.5-1.5=1,小于于1.7形成共价键,属于共价化合物;
AlCl3电负性差值为3.0-1.5=1.5,小于于1.7形成共价键,属于共价化合物;
CS2电负性差值为2.5-2.5=0,小于于1.7形成共价键,属于共价化合物;
故答案为:Mg3N2;BeCl2、AlCl3、SiC。


科目:高中化学 来源: 题型:
【题目】吸烟有害健康,青少年应远离烟草。烟草和烟气中含有多种有害有毒物质,其中剧毒物尼古丁的结构简式如图乙所示,致癌物质苯并吡的结构如图甲所示,有关其叙述正确的是
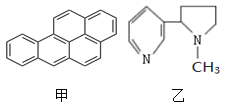
A. 尼古丁属于芳香族化合物
B. 尼古丁分子中的C、N原子均处于同一平面内
C. 苯并吡的分子式为C20H12
D. 苯并吡能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 ![]() CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验 序号 | 温度/℃ | 初始CCl4的浓度 (mol·L-1) | 初始H2的浓度 (mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | A |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为_____________。
②实验1中,CCl4的转化率A________50%(填“大于”“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值________(填序号)。
A 等于50% B 大于50% C 小于50% D 从本题资料无法判断
(2)120 ℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。

①在图中的四条线中,表示H2的起始浓度为2 mol·L-1的实验消耗CCl4的百分率变化曲线的是________(填序号)。
②根据上图曲线,氢气的起始浓度为________ mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A.检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的NH4+:试液![]() 气体
气体![]() 试纸变蓝
试纸变蓝
C.检验试液中的I-:试液![]() 黄色溶液
黄色溶液![]() 深黄色溶液
深黄色溶液
D.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
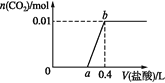
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是
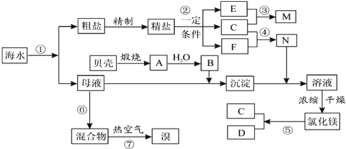
A.富集溴元素过程中,热空气吹出法利用了溴易挥发的性质
B.因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C.反应⑥所用的气态氧化剂可从本厂生产烧碱处理循环利用或从本厂生产镁单质处理循环利用
D.MgCl2·6H2O必须在氯化氢氛围条件下加热制得无水氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2(SO4)3溶液可用于腐蚀绝缘板上的铜箔,制造印刷电路板。现设计了一个方案如下,从腐蚀后的废液(主要含Fe3+、Fe2+、Cu2+)中回收铜,并重新获得Fe2(SO4)3溶液。
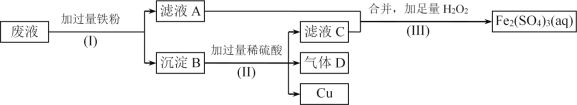
(1)步骤(I)中分离操作名称为____________________。
(2)沉淀B的主要成分有____________________,气体D的电子式为__________。
(3)写出步骤(III)中发生反应的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Ksp[Pd(OH)2]=1.0×10-30。向物质的量浓度相同的NaOH和Na2S的混合溶液中滴加Pd(NO3)2溶液产生Pd(OH)2、PdS两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。图中的p(Pd)=-lgc(Pd2+),p(B)=-lgc(OH-)或-lgc(S2-)。下列说法错误的是( )

A. 曲线Ⅰ表示的是Pd2+与OH-浓度关系的曲线
B. 该温度下,Ksp(PdS)=1.0×10 -58
C. 升高温度时,b点可能会向c点移动
D. 该温度下,向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com