
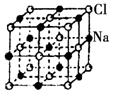
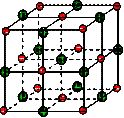
| A.与K+距离相等且最近的O2-共有8个 |
| B.与K+距离相等且最近的O2-构成的多面体是8面体 |
| C.与K+距离相等且最近的K+有8个 |
| D.一个KO2晶胞中摊得的K+和O2-粒子数均为6个 |
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
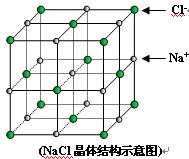
| A.NaCl | B.CsCl | C.干冰 | D.SiO2 |
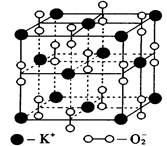
| A.K2O | B.K2O2 | C.K2O3 | D.KO2 |
| A.晶体中与每个K+距离最近的K+有8个 |
| B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ |
| C.每个 O2-周围最近且等距离的K+所围成的空间构型为正八面体 |
| D.晶体中,0价氧原子与-2价氧原子的数目比为3:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
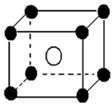
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | NaCl | AlCl3 | SiCl4 | 单质B |
| 熔点 | 810℃ | 190℃ | -68℃ | 1300℃ |
| 沸点 | 1465℃ | 183℃ | 57℃ | 2500℃ |
| A.SiCl4形成的晶体是分子晶体. | B.单质B可能是原子晶体 |
| C.电解NaCl水溶液可制得金属钠 | D.不能用电解熔融AlCl3制取单质铝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O2、I2、Hg | B.Na、K、Rb |
| C.CO2、KCl、NaCl | D.HF、HCl、HBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com