
分析 (1)称取固体需要用托盘天平,依据m=CVM计算需要溶质的质量;
(2)依据配制一定物质的量浓度溶液一般步骤选择需要仪器,判断缺少的玻璃仪器;
(3)依据配制一定物质的量浓度溶液一般步骤排序;定容时,发现液面下降是正常操作,因为部分溶于粘到瓶塞和瓶壁上;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)用无水碳酸钠固体配制1.00mol/L的Na2 CO3溶液100mL,需要用托盘天平称量碳酸钠的质量为:1.00mol/L×0.1L×106g/mol=10.6g;
故答案为:托盘天平;10.6;
(2)用固体配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、量筒、玻璃棒、容量瓶、胶头滴管,用到的玻璃仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
故答案为:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(3)用固体配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、贴标签等,所以正确的操作步骤为:deafchbg;
定容时,发现液面下降是正常操作,因为部分溶于粘到瓶塞和瓶壁上,不需要再加水到刻度线;
故答案为:deafchbg;不需要;
(4)A.没有将洗涤液转入容量瓶中,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故A选;
B.容量瓶洗涤后,未经干燥处理,含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故B不选;
C.定容时,俯视容量瓶的刻度线,导致溶液体积偏小,溶液浓度偏高,故C不选;
D.加水定容时,水的量超过了刻度线,导致溶液体积偏大,溶液浓度偏低,故D选;
故选:AD.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向上述溶液中滴加几滴NaOH溶液,溶液颜色会加深,因为OH-与Fe3+生成了红褐色沉淀 | |
| B. | 向上述溶液中滴加几滴NaOH溶液,溶液颜色会变浅,因为OH-与Fe3+生成了红褐色沉淀,使Fe3+的浓度减小,平衡逆向移动,导致Fe(SCN)3的浓度减小 | |
| C. | 向上述溶液中滴加几滴1 mol/L KSCN溶液,溶液颜色会加深,因为SCN-的浓度增大,正反应速率加快,平衡正向移动,导致导致Fe(SCN)3的浓度增大 | |
| D. | 向上述溶液中分别滴加NaOH溶液和KSCN溶液过程中,Na+、K+的浓度大小对平衡体系没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
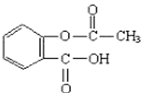
| A. | 该物质能与浓溴水发生取代反应 | B. | 该物质能发生酯化反应 | ||
| C. | 该物质属于蛋白质 | D. | 该物质极易溶于水和有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰,明矾,烧碱 | B. | 同素异形体:C60,石墨,金刚石 | ||
| C. | 非电解质:乙醇,四氯化碳,氯气 | D. | 混合物:纯净矿泉水,盐酸,漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 二氧化碳 | 碳酸钠 | 转移的电子 |
| A | lmol | 2NA | |
| B | 22.4L | lmol | |
| C | 106g | lmol | |
| D | 106g | 2NA |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下纯水PH=6,则在该条件下PH=4的醋酸和PH=10的NaOH中水的电离程度相同 | |
| B. | NH4Cl溶于D2O的离子方程式:NH4+D2O?NH3•D2O+H+ | |
| C. | 已知S燃烧热为QKJ/mol,则S(s)+$\frac{3}{2}$O2(g)═SO3(g);△H=-QKJ/mol | |
| D. | 水的自偶电离方程式:2H2O?H3O-+OH-,则液氨自偶电离:2NH3?NH4++NH2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com