解答:
解:B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;B
-离子为Cl
-离子,A
+比B
-少一个电子层,A
+为Na
+离子;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns
2np
3,是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,最高价氧化物中含D的质量分数为 40%,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素,A
+是Na
+离子,R是由Na
+离子与D
2-离子以2:1形成的离子化合物,D
2-离子是S
2-离子,R是硫化钠.
(1)钠元素属于A
2密堆积式,该晶胞含有2个原子,所以Na元素形成的晶体内晶胞类型应属于体心立方,其空间利用率为68%,
故答案为:体心立方;68%;
(2)N
3-核外有10个电子,根据构造原理知,该离子基态核外电子排布式为:ls
22s
22p
6,CB
3分子为NCl
3分子,N原子有一对孤对电子,与Cl原子成3个δ键,氮原子的杂化方式为sp
3,所以CB
3分子的VSEPR模型为四面体形,
故答案为:ls
22s
22p
6;sp
3;四面体形;
(3)C的氢化物是氨气,一体积水能溶解700体积氨气,氨气分子和水分子之间可以形成氢键,且氨气分子和水分子都是极性分子,根据相似相溶原理知,氨气极易溶于水,
故答案为:1:700溶于水或极易溶于水;氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;
(4)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以P、S、Cl元素的第一电离能大小顺序是:Cl>P>S;
同一周期元素中,元素的电负性随着原子序数的增大而增大,一般来说电负性越强,元素的非金属性越强,对应的单质的氧化性越强,如在H
2S+Cl
2=2HCl+S↓反应中,Cl
2的氧化性大于O
2的氧化性,
故答案为:Cl>P>S;H
2S+Cl
2=2HCl+S↓;
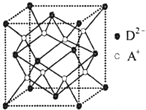
(5)该晶胞中钠离子个数=8,氧离子个数=
8×+6×=4,晶胞的体积=
cm
3,晶胞的边长=
cm,四个氧离子和一个钠离子构成正四面体,钠离子位于正四面体的体心上,

四个氧原子位于正四面体的顶点上,钠原子位于体心上,正四面体的棱长=
×cm,
设氧离子和钠离子的距离为x,
在正三角形BCD中,BE的长=
××cm,BO和OE的长之比为2:1,所以BO的长=
×××cm,(AO的边长)
2=(
×)
2-(
×××)
2,x
2=(
×××)
2+(AO的边长-x)
2,所以x=
×cm,
故答案为:
×;
(6)已知:①4Cu(s)+O
2(g)═2Cu
2O(s)△H=-337.2kJ?mol
-1②2Cu(s)+O
2(g)═2CuO(s)△H=-314.6kJ?mol
-1根据盖斯定律,②×2-①得:2Cu
2O(s)+O
2(g)=4CuO(s)△H=-292.0kJ?mol
-1,
故答案为:2Cu
2O(s)+O
2(g)=4CuO(s)△H=-292.0kJ?mol
-1.

 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.谙冋答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.谙冋答下列问题:


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案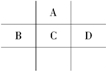 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同. (Ⅰ)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
(Ⅰ)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题: