
【题目】某有机化合物的结构式如图,其中W、X、Y、Z为原子序数依次增大的短周期元素,Y原子核外最外层电子数是其电子层数的3倍,X与Z位于不同的周期,下列有关说法正确的是

A.气态氢化物的热稳定性:X>Y
B.X、W、Z三者形成的化合物都是液体
C.W2Y2中既含极性键又含非极性键
D.Z元素形成的含氧酸全部是强酸
科目:高中化学 来源: 题型:
【题目】用系统命名法写出下列物质名称或结构简式或者对应的化学方程式:
(1) ______________________________。
______________________________。
(2)实验室制取乙炔的化学方程式为:_________________________________________。
(3)乙醇的消去反应:________________________________________________;
(4)3-甲基-1-丁烯:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是( )
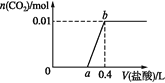
A.在0~a范围内,只发生H++OH-=H2O
B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C.a=0.2
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。

该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是____________。
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是____________ (填字母)。
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有____________。
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)= ____________。
(3)方案三:称取一定质量样品,按如图装置进行实验:
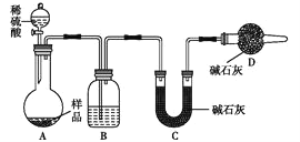
①B装置内所盛试剂是____________;
②D装置的作用是________。
③某同学认为上述测定结果__________(填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中能大量共存的是
A. 常温下,c(H+)/c(OH)=1×1012的溶液:K+、AlO2、CO32、Na+
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl、I
C. 加入Al能放出大量H2的溶液中:NH4+、Na+、NO3、SO42
D. 常温下,pH=7的溶液:Cu2+、Fe3+、NO3、SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通入足量Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程,下列说法不正确的是( )
A.上述过程中,最终被还原的是NO3-
B.从上述过程中可以得出氧化性:稀硝酸>稀硫酸>Fe3+
C.上述过程中,会产生一种无色的难溶于水的气体
D.若通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为3∶2
【答案】B
【解析】
A.SO2通入硝酸铁稀溶液中,溶液由棕黄色变为浅绿色,是因为Fe3+与SO2发生氧化还原反应生成SO42-、Fe2+;溶液立即又变为棕黄色,是因为Fe2+与NO3-、H+发生氧化还原反应生成Fe3+,所以最终被还原的是NO3-,故A正确;
B.SO2能够被Fe3+氧化成H2SO4,Fe2+能够被稀硝酸氧化成Fe3+,则氧化性:稀硝酸>Fe3+>稀硫酸,故B错误;
C.稀溶液中,NO3-在酸性环境中被还原为NO,NO是无色的难溶于水的气体,故C正确;
D.上述过程中,最终被还原的是NO3-,故整个过程相当于SO2和NO3-之间发生了氧化还原反应,由关系式3SO2~2NO3-可知,SO2与NO的体积比为3∶2,故D正确;
故答案为B。
【题型】单选题
【结束】
14
【题目】某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-的浓度,设计如图所示的实验方案:
![]()
则试剂X可以是( )
A.0.1mol·L-1KMnO4(H2SO4酸化)溶液
B.0.5mol·L-1NaOH溶液
C.新制氯水
D.KI溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
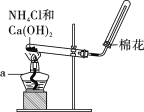
【题目】在实验室里,常用如图所示装置制取并收集氨气。请回答下列问题:
(1)原理与方法
①制取氨气的化学方程式为__________________________________;
②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法
(2)装置与操作
按下图组装仪器,进行实验。仪器a的名称为____________。
(3)思考与交流
①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g;
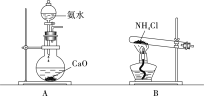
②实验室制取氨气,还可采用下图中的______(填“A”或“B”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com