
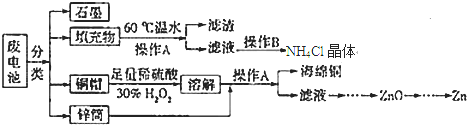

| 1mol |
| 1 |
| ||
| ||


科目:高中化学 来源: 题型:


 (5)下列关于化合物I、II、V、VI的说法正确的有
(5)下列关于化合物I、II、V、VI的说法正确的有查看答案和解析>>
科目:高中化学 来源: 题型:

| A、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、烧杯b中发生反应为Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| B | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g)?N2O4(g);△H<0 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 上层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 CO32-或 SO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通入水中,溶液呈酸性:Cl2+H2O?2H++Cl-+ClO- | ||||
B、用铜做电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| C、NaHS电离方程式:NaHS?Na++HS- | ||||
| D、NH4Cl水解反应:NH4++2H2O?NH3?H2O+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
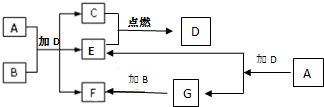 下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
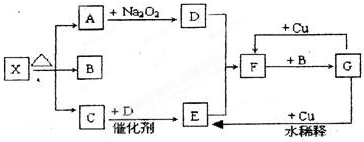
查看答案和解析>>
科目:高中化学 来源: 题型:
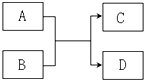 已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:
已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com