
由Ca3(PO4)2 、SiO2 、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。
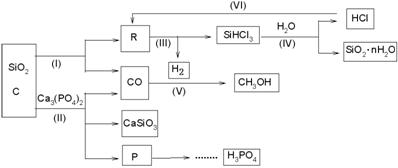
(1)上述反应中,属于置换反应的是 [选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]
(2)高温下进行的反应Ⅱ的化学方程式为: ;
固体废弃物CaSiO3可用于 。
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是 。
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 。
(5)指出(VI)这一环节在工业生产上的意义
(6)写出由P→H3PO4 有关反应式
①
②
科目:高中化学 来源: 题型:
在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2在不同浓度时的化学反应速率如表所示,由此可推知第5组实验中c(HI)、c(H2O2)不可能为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
| c(HI)/mol·L-1 | 0.100 | 0.200 | 0.150 | 0.100 | ? | 0.500 |
| c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.150 | 0.200 | ? | 0.400 |
| v/mol·L-1·s-1 | 0.007 60 | 0.015 2 | 0.017 1 | 0.015 2 | 0.022 8 | 0.152 |
A.0.150 mol·L-1、0.200 mol·L-1
B.0.300 mol·L-1、0.100 mol·L-1
C.0.200 mol·L-1、0.200 mol·L-1
D.0.100 mol·L-1、0.300 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知次氯酸是比碳酸还弱的酸,反应Cl2+H2OHCl+HClO达到平衡后,要使HClO浓度增大,可加入( )
A.NaCl固体 B.水
C.CaCO3固体 D.NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
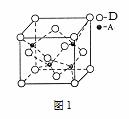
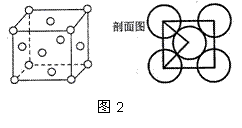
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;B的最外层电子数为其内层电子数的3倍;A与C可形成离子化合物C3A2;D是地壳中含量最多的金属元素;E原子核外的M层中有两对成对电子;F原子核外最外层只有1个电子,其余各层电子均充满。根据以上信息,回答下列问题:(A、B、C、D、E、F用所对应的元素符号表示)
F原子的核外电子排布式为 ,A、B、C、D、E的第一电离能最小的是 。
C的氧化物的熔点远高于E的氧化物的熔点,原因是 。
比较B、E的氢化物的沸点_________。
A的最高价含氧酸根离子中,其中心原子是 杂化,E的低价氧化物的空间构型为 。
A、D形成某种化合物的晶胞结构如图1,则其化学式为 。
F单质的晶体的晶胞结构如图2。若F原子的半径是r cm,则F单质的密度的计算公式是 。(用NA表示阿伏伽德罗常数)

查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
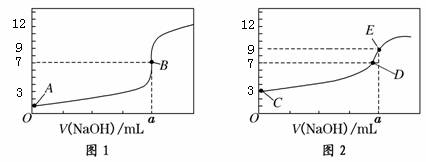
以下说法正确的是( )
A.图1是滴定CH3COOH 溶液的曲线
B.图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色
C.点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1∶100
查看答案和解析>>
科目:高中化学 来源: 题型:
X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )
A.原子序数:X<Y B. 电负性:X<Y
C.离子半径:X>Y D.原子半径:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
下列性质适合于离子晶体的是( )
A.熔点-218 ℃,难溶于水
B.熔点3 900 ℃,硬度很大,不导电
C.难溶于水,固体时导电,升温时导电能力减弱
D.难溶于水,熔点高,固体不导电,熔化时导电
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,C(s)+H2O(g)CO+H2(g) ΔH>0在一容积固定的密闭容器中放入足量的焦炭与一定量的水蒸气进行反应,下列有关图像正确的是( )
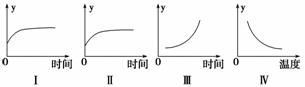
A.Ⅰ 图表示反应进行过程中气体平均相对分子质量的变化
B.Ⅱ图表示反应进行过程中气体密度的变化
C.Ⅲ图表示反应达到平衡后,移去部分焦炭后水蒸气的百分含量的变化(忽略表面积的影响)
D.Ⅳ图表示反应达到平衡后,升高温度CO的百分含量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为____________。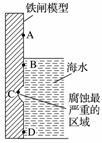
②图中A、B、C、D四个区域,生成铁锈最多的是__________(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com