
已知A为金属单质,根据下列变化判断A、B、C、D、E各是什么物质?写出有关的化学方程式(离子反应要写离子方程式)。
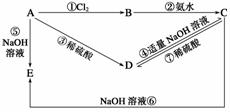
(1)A________________;B______________;
C____________________;D________________________________________________________________________;
E____________________。
(2)写出有关化学方程式(离子反应要写离子方程式):
②________________________________________________________________________;
⑤________________________________________________________________________;
⑥________________________________________________________________________;
⑦________________________________________________________________________。
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
向一定量的下列物质中逐滴加入氢氧化钠溶液,先生成白色沉淀,后沉淀逐渐溶解。这种物质是( )
A.MgSO4 B.Na[Al(OH)4]
C.AlCl3 D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组为了解Cu的常见化合物性质,运用类比的思想提出如下问题,并进行探究。
提出问题 ①通常情况下,+2价Fe不如+3价Fe稳定,+1价Cu也不如+2价Cu稳定吗?
②CuO能被H2、CO等还原,也能被NH3还原吗?
实验方案 (1)解决问题①的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80 ℃~100 ℃时,得到黑色固体粉末,继续加热到1 000 ℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器内还有红色固体存在。据此可推得A的化学式为____________。
(2)如图所示为常见气体的制备、干燥和性质验证的部分仪器装置(部分夹持装置及尾气处理装置未画出),请从中选择合适的药品和仪器装置回答问题。
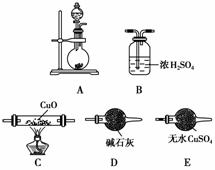
①制取干燥的NH3并还原CuO,所选仪器装置的正确连接顺序是________。
②制取NH3可选用下列药品中的________。
A.NH4Cl和Ca(OH)2 B.NH4HCO3
C.浓氨水和生石灰 D.浓氨水和固体烧碱
③若CuO能被NH3还原,实验中观察到的现象是________________________,该反应的化学方程式为__________________________。
实验结论 根据“实验方案(1)”,得出的+1价Cu和+2价Cu稳定性大小的结论是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜及其化合物之间相互转化时常伴随着颜色的变化,下列符合黑色―→红色变化的是( )
A.Cu(OH)2→CuO B.Cu→Cu2S
C.Cu2(OH)2CO3→CuO D.CuO→Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿佛加德罗常数的值,下列说法不正确的是
A.常温常压下,1mol氦气含有的原子数为NA
B.常温常压下,8g甲烷中含有的电子数为5NA
C.46gNO2和N2O4混合气体中含有的原子数为3NA
D.标准状况下,11.2L四氯化碳所含分子数 0. 5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏大[Z
B.可以采用蒸发浓缩、冷却结晶的方法从高锰酸钾溶液中获得高锰酸钾晶体
C.过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌
D.分液时,分液漏斗中下层液体从下口放出后再将上层液体从下口放出到另—烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol/L的稀硫酸。
可供选用的仪器有:
 ①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。
①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的

⑵.配制稀硫酸时,还缺少的仪器有 (写仪器名称);
⑶.经计算,配制480 mL 1 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为______ mL,量取硫酸时应选用 mL规格的量筒;
A.10 mL B.50 mL C.100 mL D.200mL
⑷.在烧杯中稀释浓硫酸的实验操作为
,若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为 。
⑸.对所配制的稀硫酸进行测定,发现其浓度大于1 mol/L,配制过程中下列各项操作可能引起该误差的原因有 ( )
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是一个非常丰富的化学资源,以海水为原料可制取Mg、氯气、Br2、碘等。
(1)写出镁在二氧化碳中燃烧的化学方程式:________________________________。
(2)下列有关海水综合利用的说法正确的是________。
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备镁
D.从海带中提取碘单质的过程不涉及氧化还原反应
(3)液溴呈________色,提取单质溴时常将氯气通入苦卤(海水晒盐后得到的母液)中,将其中的溴离子氧化,反应的离子方程式为________________________,
(4)加碘食盐中的含碘物质是________,碘加热时变成紫色的碘蒸气,这一过程叫________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com