
| A. | NH3>PH3 | B. | CO2>SiO2 | C. | SiCl4>CCl4 | D. | MgO>KCl |
分析 A.氢化物中含有氢键的物质熔沸点较高;
B.原子晶体熔沸点高于分子晶体;
C.分子晶体熔沸点与其相对分子质量成正比;
D.离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比.
解答 解:A.氢化物中含有氢键的物质熔沸点较高,氨气中含有氢键、膦中不含氢键,所以熔沸点NH3>PH3,故A正确;
B.原子晶体熔沸点高于分子晶体,二氧化碳是分子晶体、二氧化硅是原子晶体,所以熔沸点CO2<SiO2,故B错误;
C.分子晶体熔沸点与其相对分子质量成正比,相对分子质量SiCl4>CCl4,所以熔沸点SiCl4>CCl4,故C正确;
D.离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比,MgO和KCl都是离子晶体,镁离子电荷大于钾离子、氧离子电荷大于氯离子,镁离子和氧离子半径都小于钾离子和氯离子,所以氧化镁晶格能大于KCl,则熔沸点MgO>KCl,故D正确.
故选B.
点评 本题考查晶体熔沸点高低判断,明确熔沸点与晶体类型、氢键、晶格能、相对分子质量的关系即可解答,注意氢键只影响物理性质不影响化学性质,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:填空题
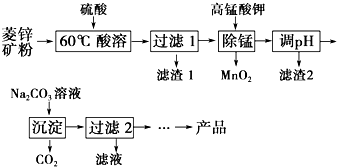 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 5.8 | 1.1 | 5.9 |
| 完全沉淀时pH | 8.8 | 3.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
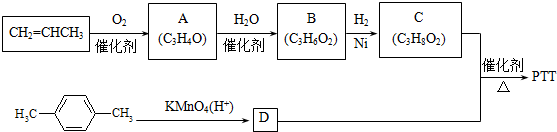
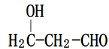 .
.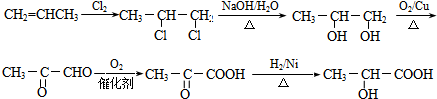 .
.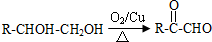
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ; F
; F  ;
;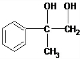 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O; +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$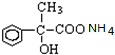 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入CCl4溶液,充分振荡静置后,分液 | |
| D. | 苯中混有苯酚,加入氢氧化钠溶液,再用分液漏斗分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力与化学键的键能大小相当 | |
| B. | 分子间作用力远强于化学键,是一种很强的作用 | |
| C. | 氢键主要影响物质的化学性质 | |
| D. | 分子内部的相邻原子之间强烈的相互作用称为化学键,而分子之间存在的相互作用称为分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半 径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要 化合价 | -4, +4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com