
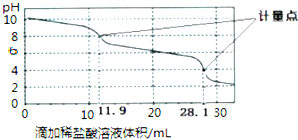
| A. | 此样品中NaHCO3的物质的量为(28.1-11.9)×10-4mol | |
| B. | 整个滴定过程中,溶液中阴离子总数始终不变 | |
| C. | 滴加稀盐酸的体积为11.90mL时:c(H+)+c(H2CO3)═c(OH-)+c(CO32-) | |
| D. | 该方法无法测定Na2CO3和NaOH混合溶液中NaOH的含量 |
分析 A.Na2CO3和NaHCO3混合物加盐酸,先是碳酸钠转化为碳酸氢钠,随后是碳酸氢钠转化为氯化钠的过程,据此计算;
B.CO32-与HCl反应生成HCO3-、Cl-,阴离子数目增加;
C.滴加稀盐酸的体积为11.90mL时,Na2CO3与HCl反应生成NaHCO3,溶液中溶质为NaHCO3,根据质子守恒分析;
D.Na2CO3和NaOH混合溶液中加入盐酸,先和氢氧化钠中和,随后是和碳酸钠之间发生反应,据此回答.
解答 解:A.Na2CO3和NaHCO3混合物加盐酸,首先是碳酸钠转化为碳酸氢钠:CO32-+H+═HCO3-,此时消耗的盐酸的体积为11.9mL,随后是碳酸氢钠转化为氯化钠的过程,HCO3-+H+═H2O+CO2↑,由于CO32-+H+═HCO3-过程和HCO3-+H+═H2O+CO2过程消耗的盐酸体积应该是相同的,所以样品中碳酸钠消耗的盐酸为2×11.9mL,则样品中碳酸氢钠消耗的盐酸n(HCl)=(28.1-2×11.9)×10-3L×0.1mol•L-1=(28.1-2×11.9)×10-4 mol,所以此样品n(NaHCO3)=(28.1-2×11.9)×10-4 mol×10=(28.1-2×11.9)×10-3 mol,故A错误;
B.Na2CO3和NaHCO3混合物加盐酸,首先是碳酸钠转化为碳酸氢钠:CO32-+H+═HCO3-,CO32-与HCl反应生成HCO3-、Cl-,阴离子数目增加,故B错误;
C.滴加稀盐酸的体积为11.90mL时,Na2CO3与HCl反应生成NaHCO3,溶液中溶质为NaHCO3,溶液中氢离子由HCO3-和H2O,则c(H+)+c(H2CO3)═c(OH-)+c(CO32-),故C正确;
D.Na2CO3和NaOH混合溶液中加入盐酸,先和氢氧化钠中和,随后是和碳酸钠之间发生反应,所以该方法能测定Na2CO3和NaOH混合溶液中NaOH的含量,故D错误.
故选C.
点评 本题考查了碳酸钠和碳酸氢钠与盐酸之间的反应知识、溶液中守恒关系的应用等,注意把握图中各个点对应的反应以及反应的先后是解题的关键,注重学生读图能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
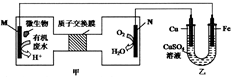 下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )
下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )| A. | 甲中H+透过质子交换膜由左向右移动 | |
| B. | M极电极反应式:H2N(CH2)NH2+4H2O-16e-═2CO2↑+N2↑+16e- | |
| C. | 一段时间后,乙中CuSO4溶液浓度基本保持不变 | |
| D. | 当N极消耗0.25molO2时,则铁极增重16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液(FeCl3):加入过量Cu后过滤 | |
| B. | Na2CO3固体(NaHCO3):加热 | |
| C. | CH3COOCH2CH3(CH3COOH):加NaOH溶液后振荡、分液 | |
| D. | Cl2(HCl):通过NaOH溶液后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数:W>Z | B. | 气态氢化物的稳定性:X<Z | ||
| C. | 最高价氧化物对应水物的碱性:Y<W | D. | Y、Z的氧化物都是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
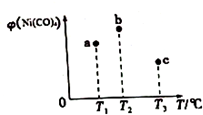 在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )| A. | 正反应为吸热反应,平衡常数:K(T1)>K(T2) | |
| B. | 反应进行到5min时,b容器中v(正)=v(逆) | |
| C. | 达到平衡时,a、b、c中CO的转化率为b>a>c | |
| D. | 减压或升温可将b中的平衡状态转变成c中的平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 早在1 000多年前,我国就已采用加热胆矾(CuSO4•5H2O)或绿矾(FeSO4•7H2O) 的方法制硫酸,尽管硫酸的生产工艺几经改进,此方法仍然是工业生产硫酸的主要方法 | |
| B. | 氢能是未来能源结构中最具发展潜力的清洁能源之一.目前已有专家研究出用淀粉或纤维素与水在酶作用下转变为二氧化碳和氢气的方法制氢气.从整个循环来看,利用该方法得到的氢能来源于太阳能 | |
| C. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 有机反应中的加聚反应符合绿色化学的原则 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
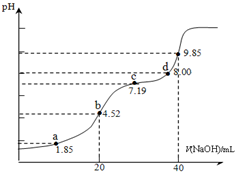 已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)>3c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | 古代文献 | 说明 | |
| A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”-《天工开物》 | KNO3能自燃 |
| B | 性质 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”-《本草纲目》 | 利用KNO3的氧化性 |
| C | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”-《本草经集注》 | 利用焰色反应 |
| D | 提纯 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”-《开宝本草》 | 溶解、蒸发、结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂甲 | 试剂乙 | 实验目的 | 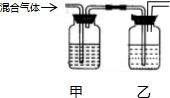 |
| A | NaOH溶液 | 浓硫酸 | 从等体积NO、NH3和NO2中分离出NO | |
| B | KMnO4溶液 | 浓硫酸 | 除去Cl2中的SO2、HCl得干燥Cl2 | |
| C | 溴水 | 浓H2SO4 | 除去乙炔中的H2S和H2O(g) | |
| D | 品红溶液 | 石灰水 | 检验混合气体HCl、SO2、CO2中的SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com