

| 1 |
| 2 |
| 1 |
| 2 |
| (8×10-4)2 |
| (0.8-4×10-4)×(0.2-4×10-4) |


科目:高中化学 来源: 题型:
| A、用来做保险丝 |
| B、用于制造航天飞机 |
| C、用来制造人造骨 |
| D、用于家庭装修,做钛合金装饰门 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动 |
| B、等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少 |
| C、等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大 |
| D、常温下10ml 0.02 mol?L-1HCl溶液与10ml 0.02 mol?L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20ml,则溶液的pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:

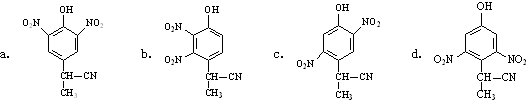
 为原料制备
为原料制备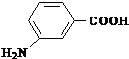 的合成路线流程图(无机试剂任选).合成路线流程图示例如图:CH2=CH2
的合成路线流程图(无机试剂任选).合成路线流程图示例如图:CH2=CH2| HBr |
| 催化剂,△ |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl |
| B、纯碱溶于热水中,去油污效果增强,说明纯碱的水解是放热反应 |
| C、为保护海轮的船壳,常在船壳上镶入锌块 |
| D、以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … | |
| R | 740 | 1 500 | 7 700 | 10 500 | … |
| A、R的最高正价为+3价 |
| B、R元素位于元素周期表中第ⅡA族 |
| C、R元素的原子最外层共有4个电子 |
| D、R元素基态原子的电子排布式为1s22s22p1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:2- 4 |
| H+ |
| 转化 |
2- 7 |
| Fe2+ |
| 还原 |
| CH- |
| 沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、③④ | D、只有① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com