
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:分析 (1)碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性;
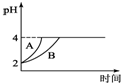
(2)pH=2的盐酸,稀释100倍后溶液的pH变为4;
(3)①向H2S溶液中加入NaOH固体时,氢离子的浓度减小,电离平衡向右移动;
②向H2S溶液中加入NaHS固体时,硫氢根离子浓度变大,H2S═HS-+H+电离平衡向左移动,硫氢根离子的电离,c(S2-)增大;
(4)醋酸为弱酸,等pH时,醋酸浓度较大,与锌反应时,醋酸进一步电离出氢离子,则醋酸的pH变化较小,醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,pH变化等量时,消耗的锌较多,以此解答;
(5)根据c(OH-)=$\sqrt{\frac{Ksp}{c(M{g}^{2+})}}$计算氢氧根离子浓度,从而确定溶液的pH,
解答 解:(1)碳酸钠为强碱弱酸盐,钠离子不水解、碳酸根离子水解导致溶液呈碱性,水解离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:碱性;CO32-+H2O?HCO3-+OH-;
(2)pH=2的盐酸,稀释100倍后溶液的pH变为4,故答案为:4;
(3)①向H2S溶液中加入NaOH固体时,氢离子的浓度减小,电离平衡向右移动,故答案为:右;减小;
②向H2S溶液中加入NaHS固体时,硫氢根离子浓度变大,H2S═HS-+H+电离平衡向左移动,硫氢根离子的电离,c(S2-)增大,故答案为:左;增大;
(4)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(5)0.002mol•L-1MgSO4溶液中c(Mg2+)=0.002mol/L,沉淀平衡时c(OH-)=$\sqrt{\frac{Ksp}{c(M{g}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-11}}{0.002}}$mol/L=10-4 mol/L,则c(H+)=10-10 mol/L,所以溶液的pH=-lgc(H+)=10,故应调整溶液pH大于10,故答案为:10.
点评 本题考查了弱电解质的电离、盐的水解、弱电解的稀释的理解应用、溶度积有关计算、盐类水解等知识点,是高考的热点,应熟练掌握,难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:填空题
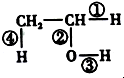 (1)在烷烃分子中,每增加一个碳原子,1mol 烷烃完全燃烧需要多消耗氧气(填字母)B.
(1)在烷烃分子中,每增加一个碳原子,1mol 烷烃完全燃烧需要多消耗氧气(填字母)B.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
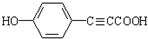
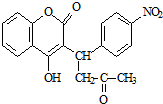 ,醋硝香豆素可以通过以下方法合成(部分反应条件省略).
,醋硝香豆素可以通过以下方法合成(部分反应条件省略).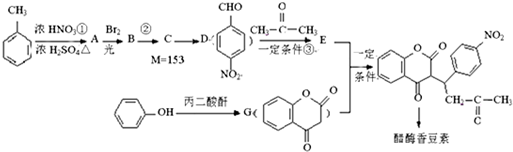
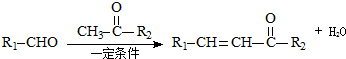
 ;反应②的反应类型水解反应或取代反应.
;反应②的反应类型水解反应或取代反应.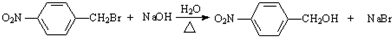 .
.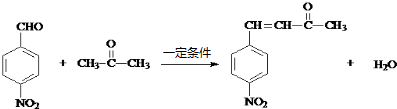 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 化学是一门以实验为基础的学科.
化学是一门以实验为基础的学科.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com