用NA表示阿伏加德罗常数,下列说法正确的是( )
①36g D2O含有的电子数为20NA;
②15.6g Na2O2 与过量CO2反应时,转移的电子数为0.2NA;
③含4mol HCl的浓盐酸与足量MnO2混合加热,转移电子数为2NA;
④在标准状况下,22.4LCH2Cl2的物质的量为1mol;
⑤标况下,2.24LSO3中含有0.1NA个SO3分子;
⑥6.4gCu与过量硫粉反应,转移电子数为0.1NA.
A.②⑥
B.③⑤
C.②④
D.②⑤
【答案】
分析:①质量换算物质的量结合分子结构计算电子数;
②质量换算物质的量,结合化学方程式计算电子转移数;
③依据浓盐酸随着反应进行,浓度变稀后不再与二氧化锰反应;
④依据气体摩尔体积的应用条件分析;
⑤依据气体摩尔体积的应用条件分析;
⑥质量换算物质的量,结合铜与硫单质反应的产物分析计算;
解答:解:①36g D
2O物质的量=
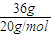
=1.8mol,含有 电子数为1.8mol×10×NA=18N
A;故①错误;
②15.6g Na
2O
2 物质的量为0.2mol,Na
2O
2 与过量CO
2反应时,过氧化钠是自身氧化还原反应,2Na
2O
2+2CO
2=2Na
2CO
3+O
2;每2mol过氧化钠反应电子转移2mol,所以0.2mol过氧化钠反应转移的电子数为0.2N
A;故正确;
③含4mol HCl的浓盐酸与足量MnO
2混合加热,随着反应进行浓盐酸浓度变稀后不再与二氧化锰进行反应,所以4molHCl不能全部反应,故转移电子数不是2N
A;故③错误;
④标准状况下,CH
2Cl
2不是气体,所以22.4LCH
2Cl
2的物质的量不是1mol;故④错误;
⑤标况下,三氧化硫是固体,2.24LSO
3物质的量不一定是1mol,不一定含有0.1N
A个SO
3分子;故⑤错误;
⑥6.4gCu物质的量为0.1mol,与硫反应的化学方程式:2Cu+S
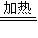
Cu
2S,铜化合价从0价变化为-1价,所以0.1mol铜反应转移电子数为0.1mol,即0.1N
A;故⑥正确;
综上所述②⑥正确;
故选A.
点评:本题考查了阿伏伽德罗常数的应用,主要是质量换算物质的量计算微粒数,氧化还原反应的电子转移数的计算,气体摩尔体积的应用条件,过氧化钠的性质,关键是铜与硫反应的产物判断和电子转移的计算.

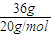 =1.8mol,含有 电子数为1.8mol×10×NA=18NA;故①错误;
=1.8mol,含有 电子数为1.8mol×10×NA=18NA;故①错误;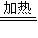 Cu2S,铜化合价从0价变化为-1价,所以0.1mol铜反应转移电子数为0.1mol,即0.1NA;故⑥正确;
Cu2S,铜化合价从0价变化为-1价,所以0.1mol铜反应转移电子数为0.1mol,即0.1NA;故⑥正确;

 53随堂测系列答案
53随堂测系列答案