
��11�֣���֪��298Kʱ��N2(g)+3H2(g)![]() 2NH3(g) ��H = ��92.2kJ��mol��1��
2NH3(g) ��H = ��92.2kJ��mol��1��
��1����N��N�ļ���Ϊ941.3 kJ��mol��1��H-H�ļ���Ϊ436.4 kJ��mol-1����N-H�ļ���Ϊ �� ��
��2��ʵ���ҽ�1.1mol N2��3mol H2����2 L������һ�������·�Ӧ��
����2 minĩ���H2�����ʵ���Ϊ1.8 mol�����ʱ����ڰ�����ƽ����Ӧ����Ϊ �� ��
�����д�ʩ�ɼӿ�÷�Ӧ���ʵ��� �� ��
A������He�� B��ʹ��ǡ���Ĵ���
C�����߷�Ӧ��ϵ���¶� D���ٳ���N2
�۵��������������ֲ���ʱ�������÷�Ӧһ�����ڻ�ѧƽ��״̬���� �� ��
A.������N2��H2��Ũ�ȱ� B.�����������ܶ�
C.����������ѹǿ D.H2�����ʵ���
�ܳ�ַ�Ӧ��ָ���298K����Ӧw*w^w.k&s#5@u.c~o*m�����зų������� �� 92.2kJ������������������������������� �� ��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ��ѧ�� | H-H | N-H | N��N |
| ����/kJ?mol-1 | 436 | 391 | 945 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧ�� | H-H | N-H | N��N |
| ����/kJ?mol-1 | 436 | 391 | 946 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
I�����������ø�Ч�ʵ������ྦྷ������ء������ʸֻ�����������ʴ���϶�߿�Ȳ��ϣ�ʹ���Ƚ�����ղ�ѹ���ռ����庸�ӹ������졣
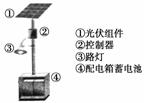 ��1����ͼ��̫���ܵ�ذ徭̫��������ǰ���ڲ����ӵı仯�����ͼ���е��ݱ���������____(��д��N����P��)��������
��1����ͼ��̫���ܵ�ذ徭̫��������ǰ���ڲ����ӵı仯�����ͼ���е��ݱ���������____(��д��N����P��)��������
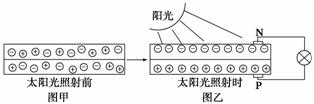
![]() ��2������ͼ��һ��̫����·�ƣ�ͼ�еĢ������ء������ؾ�������һ����̫���ܵ������ʹ�õ����أ��������ڳ�磬ҹ�乩�硣���������������ŵ�ѭ������Ҳ�ϳ��������ص��ܷ�ӦΪNi(OH)2�� ��NiOOH��1/2H2���������صĵ��Һ����30%��KOH��Һ�������練Ӧʱ��������ӦʽΪ��������������������������ҹ��ŵ�ʱ������������Һ��pH________(���������С�����䡱)��
��2������ͼ��һ��̫����·�ƣ�ͼ�еĢ������ء������ؾ�������һ����̫���ܵ������ʹ�õ����أ��������ڳ�磬ҹ�乩�硣���������������ŵ�ѭ������Ҳ�ϳ��������ص��ܷ�ӦΪNi(OH)2�� ��NiOOH��1/2H2���������صĵ��Һ����30%��KOH��Һ�������練Ӧʱ��������ӦʽΪ��������������������������ҹ��ŵ�ʱ������������Һ��pH________(���������С�����䡱)��
 II��X��Y��Z��Q��R5�ֶ�����Ԫ��ԭ���������������������X��Z��Q3��Ԫ����ɣ������£�0.1mol��L-l����Һ��pH =13����ҵ�ϳ��õ��QR������Һ������
II��X��Y��Z��Q��R5�ֶ�����Ԫ��ԭ���������������������X��Z��Q3��Ԫ����ɣ������£�0.1mol��L-l����Һ��pH =13����ҵ�ϳ��õ��QR������Һ������
��3��Q��ԭ�ӽṹʾ��ͼΪ
��4�������½�R�ĵ���ͨ�˼���Һ�У�������Ӧ�����ӷ���ʽΪ
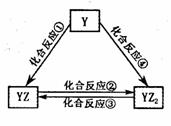
��5����YԪ�صĵ����ܷ�������ͼ��ʾת������YԪ���� ��
��֪��298Kʱ����Ӧ������1mol YZ2��g��ʱ�ų�����283.O kJ��mol-1��
��Ӧ������1mol YZ2��g��ʱ�ų�����393.5 kJ��mol-1����Ӧ�۵��Ȼ�ѧ����ʽΪ
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com