
| A. | 聚乳酸是一种纯净物 | |
| B. | 聚乳酸的聚合方式与聚苯乙烯相似 | |
| C. | 聚乳酸的单体为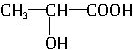 | |
| D. | 聚乳酸的降解过程不需要其他物质参与反应 |
分析 乳酸为CH3-CH(OH)-COOH,含有羟基、羧基,发生缩聚反应生成 ,为聚乳酸,以此解答该题.
,为聚乳酸,以此解答该题.
解答 解:A.从聚乳酸结构可知,聚乳酸是高分子化合物,因高分子化合物中的n值不定,故其为混合物,故A错误;
B.根据聚乳酸的结构可知,该物质是乳酸羟基和羧基脱水的产物,属于缩聚反应,聚苯乙烯是由单体:CH2=CH-C6H5碳碳双键加聚而成,故B错误;
C. 为聚乳酸的单体,故C正确;
为聚乳酸的单体,故C正确;
D.在乳酸菌作用下完全降解,故D错误.
故选C.
点评 本题考查高聚物的结构和性质,为高频考点,侧重于双基的考查,有利于培养学生良好的科学素养,答题时注意把握有机物的结构特点和官能团的性质,该题注意加聚和缩聚的区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 18g H2O在标准状况下的体积是22.4L | |
| B. | 常温常压下,4g H2含有的分子数为 2NA | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 17g氨气所含原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打溶液和NaAlO2溶液反应可以产生沉淀和气体,可以用作泡沫灭火器成分 | |
| B. | 侯德榜制碱过程涉及溶解度差异的原理,工业上从铝土矿制备较高纯度Al2O3的主要工艺流程中使用到CO2气体 | |
| C. | 一定条件下,Na、Mg、Fe都能和水反应生成对应的碱和氢气,Na2O2、MgO、Fe3O4都是碱性氧化物 | |
| D. | 纳米Fe、纳米Cu的化学活性都比原来增强,两者都能与盐酸反应生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 | 实验原理 |
| A | 用普通酒精精制无水酒精 | 加入硫酸铜,蒸馏 | 硫酸铜吸水 |
| B | 除去乙醇中少量乙酸 | 加入钠,分液 | 乙酸与钠反应 |
| C | 分离甲酸丙酯和丙酸甲酯 | 蒸馏 | 它们的沸点不同 |
| D | 除去硝基苯中少量稀酸溶液 | 加入石油醚,萃取 | 石油醚溶解硝基苯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
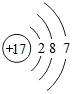 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备乙烯时,产生的气体使溴水褪色,能证明有乙烯生成 | |
| B. | 加热NaOH和少量溴乙烷的混合液后滴加硝酸银,可生成浅黄色沉淀 | |
| C. | 制取硝基苯时,试管中先加入浓H2SO4,再逐滴滴入浓HNO3和苯,振荡混合均匀后,保持55℃水浴加热 | |
| D. | 除去溴苯中的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
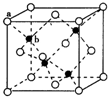 E、G、M、Q、T是五种原子序数依次增大的前四周期元素E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与QM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与QM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: (若有配位键,请用“→”表示),E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性;
(若有配位键,请用“→”表示),E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性; 查看答案和解析>>
科目:高中化学 来源: 题型:多选题
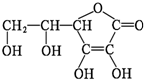 维生素C是一种重要的维生素,能防治坏血病,又称为抗坏血酸,其结构简式如图,下列有关它的叙述错误的是( )
维生素C是一种重要的维生素,能防治坏血病,又称为抗坏血酸,其结构简式如图,下列有关它的叙述错误的是( )| A. | 它的分子式为C6H8O6 | B. | 易起氧化及加成反应 | ||
| C. | 它是一种脂溶性维生素 | D. | 在碱性溶液中不能稳定地存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
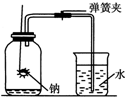 某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.
某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com