
| A. | 第1A族均为碱金属元素 | |
| B. | 最外层有两个电子的原子一定在第ⅡA族 | |
| C. | 元素的最高化合价等于其原子的最外层电子数 | |
| D. | 第ⅦA族元素的阴离子还原性越强,其气态氢化物的稳定性越弱 |
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol酸与1mol碱发生中和反应时所释放的热量称为中和热 | |
| B. | 放热的反应在常温下不一定很容易发生 | |
| C. | 化学反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 | |
| D. | 化学反应的本质是旧键的断裂和新键的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
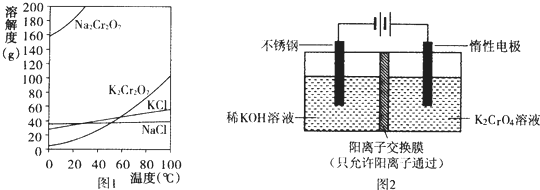
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B>A>C | B. | A>C>B | C. | A>B>C | D. | B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
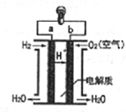
| A. | b极是负极 | B. | 正极发生氧化反应 | ||
| C. | a极的电极反应是H2-2e-=2H+ | D. | 该电池工作时,有淡蓝色火焰产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
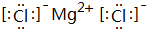 ,其中所含化学键的类型是离子键.
,其中所含化学键的类型是离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
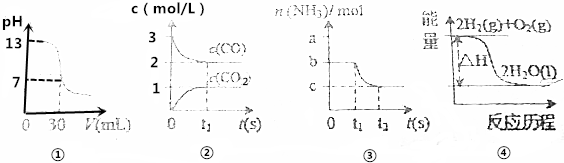
| A. | 图①表示25℃时,0.1000mol•L-1某一元酸滴定25.00mL 0.1000mol•L-1NaOH溶液,则根据图中数据可以计算出该温度下该一元酸的电离常数Ka | |
| B. | 图②表示某温度下的反应2CO(g)?C(s)+CO2(g)中的气体浓度随时间变化的曲线,则根据图中数据可计算该温度下的平衡常数K | |
| C. | 图③表示N2(g)+3H2(g)?2NH3(g)的平衡移动曲线,t1时刻改变的条件可能是降低压强 | |
| D. | 图④表示的反应热△H,可根据H2、O2、H2O的共价键的键能计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性比硫强 | B. | 阴离子比Br-半径小 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com