
| A、5 | B、3 | C、2 | D、1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
| B、NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C、一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D、若反应中转移的电子数目为6.02×1023,生成22.4L NO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何纯净物都含有相同的分子数 |
| B、1molO2中约含有6.02×1023个氧分子 |
| C、1mol氢中含有2mol氢原子 |
| D、阿伏加德罗常数就是6.02×1023mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.2mol |
| B、3.2mol |
| C、4.4mol |
| D、4.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
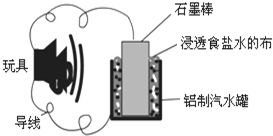 利用生活中常见的材料可以进行很多科学实验,如图就是一个用废旧材料制作的可用于驱动玩具的电池示意图.当电池工作时,有关说法正确的是( )
利用生活中常见的材料可以进行很多科学实验,如图就是一个用废旧材料制作的可用于驱动玩具的电池示意图.当电池工作时,有关说法正确的是( )| A、铝罐将逐渐被腐蚀 |
| B、石墨棒应与玩具电机的负极相连 |
| C、石墨棒上发生的反应为:O2+2H2O-4e-═4OH- |
| D、该电池工作一段时间后石墨棒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质说法不正确为( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质说法不正确为( )| A、不能使紫色石蕊变红 |
| B、与碳酸钠反应 |
| C、能发生酯化反应 |
| D、能发生氧化反应催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能与酸反应生成盐和水的氧化物一定是碱性氧化物 |
| B、把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用 |
| C、将Ba(OH)2溶液滴到明矾溶液中,当SO42-恰好沉淀完全时,铝只以AlO2-形式存在 |
| D、在含有Cu(NO3)2、Mg(NO3)2、Fe(NO3)3溶液中加入过量锌粉,最先被还原的是Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液和少量MnSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com