
【题目】相对分子质量为Mr的气态化合物V L(标准状况)溶于mg水中,得到溶液的质量分数为w%,物质的量浓度为cmol·L-1,密度为ρg·cm-3,则下列说法不正确的是( )
A.溶液密度ρ可表示为![]()
B.物质的量浓度c可表示为![]()
C.溶液的质量分数w%可表示为![]()
D.相对分子质量Mr可表示为![]()
【答案】C
【解析】
A.设溶液体积为xcm3,根据密度ρ=![]() 计算;
计算;
B.先根据m=nM计算出该气体得到质量,从而可知所得溶液质量,然后根据V=![]() 计算出溶液体积,最后根据c=
计算出溶液体积,最后根据c=![]() 计算出该溶液的浓度c;
计算出该溶液的浓度c;
C.根据溶质质量分数w%=![]() 计算;
计算;
D.先根据n=![]() 计算出该气体的物质的量,再结合水的质量、溶质质量分数计算出溶液中含有该气体质量,最后根据M=
计算出该气体的物质的量,再结合水的质量、溶质质量分数计算出溶液中含有该气体质量,最后根据M=![]() 计算出其摩尔质量。
计算出其摩尔质量。
A.设溶液体积为xcm3,该溶液中含有溶质的质量为:Mrg/mol×cmol/L×x×103L=cMx×103g,该溶液质量为:![]() ,该溶液的密度为:ρ=
,该溶液的密度为:ρ=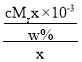 gcm3=
gcm3=![]() gcm3,故A正确;
gcm3,故A正确;
B.该气体的物质的量为![]() mol,该气体质量为:
mol,该气体质量为:![]() mol×Mrg/mol=
mol×Mrg/mol=![]() g,所得溶液质量为:mg+
g,所得溶液质量为:mg+![]() g,所得溶液的体积为:
g,所得溶液的体积为: =
=![]() L,则该溶液的物质的量浓度为:c=
L,则该溶液的物质的量浓度为:c=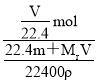 =
=![]() mol/L,故B正确;
mol/L,故B正确;
C.该气体质量为![]() g,所得溶液质量为(m+
g,所得溶液质量为(m+![]() )g,该溶液的质量分数为w%=
)g,该溶液的质量分数为w%=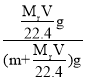 =
=![]() ,故C错误;
,故C错误;
D.标准状况下VL气体的物质的量为:![]() =
=![]() mol,水的质量分数为1w%,该溶液中含有该气体的质量为:
mol,水的质量分数为1w%,该溶液中含有该气体的质量为:![]() =
=![]() g,则该气体的摩尔质量为:M=
g,则该气体的摩尔质量为:M=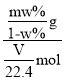 =
=![]() g/mol,该气体的相对分子质量为
g/mol,该气体的相对分子质量为![]() ,故D正确;
,故D正确;
故答案选C。


科目:高中化学 来源: 题型:
【题目】如图所示,烧杯中盛有水,铁圈和银圈直接相连,在接头处用一根绝缘细丝吊住使之平衡。小心向烧杯中滴加少量CuSO4溶液,反应一段时间。下列有关说法不正确的是
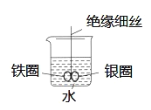
A.两圈摇摆不定
B.铁圈不断腐蚀
C.银圈上慢慢看到有红色物质覆盖
D.利用该原理,可以设计原电池装置,将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种高效氧化剂可用来氧化吸附有机异味物.也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2O42-+2MnO4-+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的_______区,基态Mn2+的核外电子排布式可表示为_____。
(2)1 mol [Mn( H2O)6]2+中所含有的共价键数目为__________。
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为_______.C2O42-中碳原子的轨道杂化类型是___________________.
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:H2O>H2Se>H2S,原因是__________。
(5)β-MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
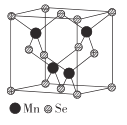
①β-MnSe中Mn的配位数为_____________。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为______pm, β-MnSe 的密度ρ= ______ ( 列出表达式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,某烃和氧气的混合气体4L,点燃后恰好完全燃烧,通过浓硫酸后恢复到原来状态,体积变为2L。则符合题意的某烃为( )
A.C4H8B.C3H8C.C2H2D.CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二苯甲酮广泛应用于药物合成,同时也是有机颜料、杀虫剂等的重要中间体。实验室以苯与苯甲酰氯为原料,在AlCl3作用下制备二苯甲酮的实验流程如下图所示:

相关物理常数和物理性质如下表:
名称 | 相对分 子质量 | 密度/g·cm-3 | 熔点/oC | 沸点/oC | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
苯甲酰氯 | 140.5 | 1.22 | 1 | 197 | 遇水分解 |
无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
二苯甲酮 | 182 | 1.11 | 48.5 | 305(常压) | 难溶水,易溶苯 |
已知:反应原理为: 。该反应剧烈放热。
。该反应剧烈放热。
回答下列问题:
(1)反应装置如图所示(加热和夹持装置已略去),迅速称取7.5 g无水三氯化铝放入三颈瓶中,再加入30 mL无水苯,搅拌,缓慢滴加6 mL新蒸馏过的苯甲酰氯。反应液由无色变为黄色,三氯化铝逐渐溶解。混合完后,保持50℃左右反应1.5~2 h。
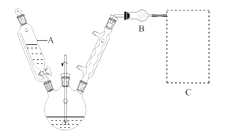
仪器A的名称为_______。装置B作用为_______。缓慢滴加苯甲酰氯的原因是______。能作为C中装置的是_______(填标号)。

(2)操作X为___________。
(3)NaOH溶液洗涤的目的是_____________。
(4)粗产品先经常压蒸馏除去__________,再减压蒸馏得到产品。
(5)当所测产品熔点为________时可确定产品为纯品。已知实验最终所得纯品8.0 g,则实验产率为_________ %(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. NCl3分子是非极性分子
C. NBr3比NCl3易挥发
D. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(?) ![]() zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
A. 各物质的计量数一定满足:x+y=z
B. 若B为气体,压缩后B的体积分数增大,转化率降低
C. 无论B为固体或气体,压缩后B的质量都不会改变
D. 压缩时,平衡向逆反应方向移动,且正、逆反应速率都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com