
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:分析 (1)水的电离是吸热过程,降低温度抑制水电离,导致水中c(H+)、c(OH-)都减小;
(2)在25℃时,Kw=10-14,溶液中存在离子积常数,据此计算;
(3)先根据温度和混合溶液pH大小确定溶液的酸碱性,根据溶液的pH计算酸和碱的体积之比;
(4)图中可知.在95℃时,Kw=10-12,c(H+)=10-6mol/L,纯水的PH为6,此温度下将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液为中性,溶液中氢离子物质的量和氢氧根离子物质的量相同.
解答 解:(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性,则95℃时水的电离平衡曲线应为B,
故答案为:B;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
(2)在25℃时,0.01mol/L的NaOH溶液中c(OH-)=0.01mol/L,c(H+)=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,溶液PH=12,PH为11的Ba(OH)2溶液中氢氧根离子浓度c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,Ba(OH)2=Ba2++2OH-,Ba(OH)2的物质的量浓度为:5×10-4mol/L,
故答案为:12;5×10-4mol/L;
(3)25°C时纯水的pH=6,混合溶液的pH=7,说明酸、碱混合呈中性,pH=9的NaOH溶液c(OH-)=10-5 mol/L,pH=4的H2SO4溶液(H+)=10-4mol/L,
设酸的体积为x,碱的体积为y,10-5 mol/L×y=10-4mol/L×x,y:x=10:1;
故答案为:10:1;
(4)图中可知.在95℃时,Kw=10-12,c(H+)=10-6mol/L,纯水的PH为6,此温度下将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液为中性,溶液中氢离子物质的量和氢氧根离子物质的量相同,设氢氧化钠溶液体积为V(碱),硫酸溶液体积为V(酸),则得到:$\frac{1{0}^{-14}}{1{0}^{-9}}$×V(碱)=10-4×V(酸),得到V(碱):V(酸)=1:10,
故答案为:6,1:10.
点评 本题考查水的电离和酸、碱混合的pH计算问题,题目难度中等,注意温度不同而使水的离子积常数不同是解本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
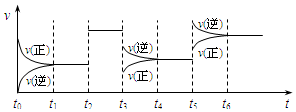 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率一定最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 △H=+124kJ•mol-1
△H=+124kJ•mol-1| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
 △H2>0
△H2>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com