
 .
.
分析 X是短周期中原子半径最小的元素,是氢元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝,则甲为氨气,则Y是N元素;
(1)N的原子结构示意图是 ;
;
(2)氨气的水溶液与硫酸铝溶液反应离子方程式3NH3?H20+Al3+=Al(OH)3↓+3NH4+;
(3)氨气与氯化氢反应生成氯化铵,氯化铵中所含化学键类型有铵根离子与氯离子之间形成的离子键和氮与氢之间形成的共价键;氯化铵是强酸弱碱盐水解呈酸性,离子浓度大小:不水解的离子>水解的弱离子>显性离子>隐性离子;
(4)①合成氨的反应是体积减少的反应,所以可以通过增大压强,加快化学反应的速率,提高氨气的转化率;
②(i)平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,正反应是放热反应,温度越高K值越小;
(ii)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答 解:(1)X是短周期中原子半径最小的元素,是氢元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝,则甲为氨气,则Y是N元素,N的原子结构示意图是 ,
,
故答案为: ;
;
(2)氨气的水溶液与硫酸铝溶液反应离子方程式3NH3?H20+Al3+=Al(OH)3↓+3NH4+,
故答案为:3NH3?H20+Al3+=Al(OH)3↓+3NH4+;
(3)氨气与氯化氢反应生成氯化铵,氯化铵中所含化学键类型有铵根离子与氯离子之间形成的离子键和氮与氢之间形成的共价键;氯化铵是强酸弱碱盐水解呈酸性,离子浓度大小:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:离子键和共价键;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)①合成氨的反应是体积减少的反应,所以可以通过增大压强,加快化学反应的速率,提高氨气的转化率,
故答案为:增大压强;
②平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,所以K=$\frac{c[CO(N{H}_{2})_{2}]×c({H}_{2O})}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$,正反应是放热反应,温度越高K值越小,
故答案为:$\frac{c[CO(N{H}_{2})_{2}]×c({H}_{2O})}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$;减小;
(ii)①2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)△H1=-536.1kJ•mol-1,
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-1806.4kJ•mol-1
依据盖斯定律②-①×2得到CO(NH2)2(g)与NO反应的热化学方程式2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2 kJ/mol;
故答案为:2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2 kJ/mol.
点评 本题考查了原子结构、离子方程的书写,化学平衡、反应速率影响因素分析和化学平衡常数表达式,综合性较强,掌握好元素的结构和性质、化学反应原理是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH增大 | B. | c(CH3COOH)增大 | ||
| C. | CH3COOH电离程度增大 | D. | c(H+)×c(OH-)=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加的反应一定是氧化还原反应 | |
| B. | 没有氧元素参加的反应一定不是氧化还原反应 | |
| C. | 在氧化还原反应中,某元素由化合态变为游离态,该元素可能被氧化,也可能被还原 | |
| D. | 复分解反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
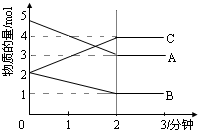 某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤⑥ | C. | ②④⑥⑦ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子的还原性强弱:Fe2+>Br->Cl- | |
| B. | 当氯气少量时,发生的离子反应:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 当a=b时,反应后溶液的离子浓度:c(Fe3+):c(Br-):c(Cl-)=1:2:2 | |
| D. | 当氯气过量时,发生离子反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com