
.甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
①CH30H(g)=CH20(g)+H2(g) △H1=+84.2kJ·mol-1
向反应体系中通入氧气,通过反应②2H2(g)+O2(g)=2H2O(g) △H2=-483.6 kJ·mol-1 提供反应①所需热量,要使反应温度维持在700°c,则进料中甲醇与氧气的物质的量之比为
A.5.74:1 B.11.48:1 C.1:l D.2:l
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
 (2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.
(2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
科目:高中化学 来源:2009届上海市南汇中学高三年级零次月考、化学试卷 题型:022
有机物A是一种重要的化工生产的中间体,已知结构简式为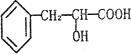
(1)A中含的官能团有:________.
(2)A可能具有的化学性质有:________.(填序号)
①能与H2发生加成反应
②能与甲醇发生酯化反应
③能与甲醛发生酯化反应
④在浓硫酸和加热的条件下发生消去反应
⑤能与Ag(NH3)2OH溶液发生氧化反应
(3)在一定条件下,用有机物A可以合成高分子化合物C[(C9H8O2)n].请写出反应的化学方程式(要求有机物写结构简式)________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
A.生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式_________________________。
(2)根据等电子原理,写出CO分子的结构式______________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是_____________________;甲醛分子中碳原子轨道的杂化类型为_____________________。
②甲醛分子的空间构型是_____________________;1 mol甲醛分子中σ键的数目为_____________________。

③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________。
B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:

环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3, | 溶解性 |
环己醇 | 161.1(97.8)* | 0.962 4 | 能溶于水 |
环己酮 | 155.6(95)* | 0.947 8 | 微溶于水 |
水 | 100.0 | 0.998 2 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~
①酸性Na2Cr2O7溶液的加料方式为_____________________。
②蒸馏不能分离环己酮和水的原因是_____________________。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~
①上述操作的正确顺序是_______________________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需_______________。
③在上述操作c中,加入NaCl固体的作用是_______________________________________
______________________________________________________________________________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有______________种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(08上海建平中学期末)国家质检总局查处了在食品中使用“雕白块”七大案例。“雕白块”的化学名称为甲醛次硫酸氢钠(NaHSO2?CH2O),违法者往食品中添加“雕白块”是为了漂白增色、防腐、增加米面制品的韧性及口感。但人食用“雕白块”后会刺激肠道,引起过敏和食物中毒,容易致癌。已知“雕白块”是甲醛和次硫酸氢钠(可表示成Na+[OSOH]-)反应制得:
![]()
回答下列问题:
(1)“雕白块”_______________(填“易”或“微”或“难”)溶于水。“雕白块”具有________(填“强还原性”或“强氧化性”), 已知“雕白块”溶液中滴加足量碘水反应生成的产物中有甲醛,写出化学方程式_____________________________________。
(2)写出次硫酸氢根的电子式___________________________。
(3)写出水溶液中次硫酸氢钠和氢氧化钾反应的离子方程式__ 。
(4)甲醛能使__________变性凝固,所以可用其浓溶液保存动物标本。
(5)甲醛是非常重要的合成原料。纯净的甲醛在[F3B←O(CH2CH3)2]配位化合物的催化下,加聚生成聚甲醛(是一种优良的工程塑料),聚甲醛的结构简式为_____________;俄国化学家布特列洛夫在1861年首次发现在弱碱作用下,6个甲醛分子加合得到己糖,此己糖的分子式为___________。
(6)已知

其中A可还原新制的氢氧化铜悬浊液,亦可与乙酸发生酯化反应;B的相对分子质量是甲醛的整数倍,自然界中常以盐的形式存在于多种植物的细胞膜中,B可洗除衣物上的铁锈渍。完成下列填空:
A的同分异构体有(写出结构简式)__________________________________。
A催化加氢的化学方程式____________________________________________。
B可被酸性高锰酸钾溶液氧化,写出B跟稀硫酸、高锰酸钾混合溶液反应的反应式_____
查看答案和解析>>
科目:高中化学 来源:2010年陕西省高考化学适应训练试卷(六)(解析版) 题型:解答题
 由CO与H2催化合成甲醇是生物质能利用的方法之一.
由CO与H2催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com