
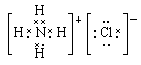 ;离子、极性(4) S2- +Cl2 ===S↓+2Cl-
;离子、极性(4) S2- +Cl2 ===S↓+2Cl-

 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:不详 题型:单选题
| A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强 |
| B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
| C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| D.第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.20Ne和22Ne互为同位素 | B.20Ne和22Ne互为同分异构体 |
| C.20Ne和22Ne的质量数相同 | D.20Ne和22Ne的中子数相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.12 mol | B.14 mol | C.16 mol | D.18 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在金属与非金属的交界处可以找到良好的半导体材料 |
| B.在过渡元素中可以寻找催化剂及耐高温和耐腐蚀的合金材料。 |
| C.在元素周期表的左下角可以寻找制备新型农药材料的元素 |
| D.目前使用的元素周期表中,最长的周期含有32种元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com