
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: 。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
共价键 | C—C | C—N | C—S |
键能/(kJ·mol-1) | 347 | 305 | 259 |
(2)C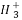 、—CH3(甲基)、C
、—CH3(甲基)、C 都是重要的有机反应中间体,有关它们的说法中正确的是( )
都是重要的有机反应中间体,有关它们的说法中正确的是( )
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.C 与NH3、H3O+互为等电子体,几何构型均为三角锥形
与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.C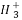 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3(甲基)或一个C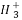 和一个C
和一个C 结合均可得到CH3CH3
结合均可得到CH3CH3
(3)金属阳离子含未成对电子越多,则磁性越强,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如下图所示,其分子内不含有 (填序号)。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键

(1)紫外光具有的能量比蛋白质分子中主要化学键C—C、C—N和C—S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子 sp2和sp3
(2)CDE
(3)CrO2 (4)AC
【解析】(2)—CH3(甲基)是甲烷去掉一个氢原子,而C 、C
、C 是在—CH3基础上失去、得到一个电子形成的,其电子数分别为8、10,A、B选项均错;C
是在—CH3基础上失去、得到一个电子形成的,其电子数分别为8、10,A、B选项均错;C 中的孤电子对数=
中的孤电子对数= =1,所以C
=1,所以C 、NH3、H3O+中的孤电子对数均为1,均形成3个σ键,均采用sp3杂化,C选项正确;C
、NH3、H3O+中的孤电子对数均为1,均形成3个σ键,均采用sp3杂化,C选项正确;C 中的孤电子对数=
中的孤电子对数= =0,D选项正确;(3)V5+、Cr4+的核外电子排布式为1s22s22p63s23p6、[Ar]3d2;(4)不属于离子化合物,更不属于金属晶体
=0,D选项正确;(3)V5+、Cr4+的核外电子排布式为1s22s22p63s23p6、[Ar]3d2;(4)不属于离子化合物,更不属于金属晶体


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(解析版) 题型:填空题
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC[Al2(OH)nCl6-n]的流程如下:

(1)粉碎煤矸石的目的是__________________________________________________;
滤渣Ⅰ的主要成分是________(填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中的有色离子为_____
________(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为_________;步骤①的煮沸装置上方需安装一长导管,长导管的作用是__________________________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是________
_______________________;已知BAC的分散质粒子大小在1~100 nm之间,由此区别滤液Ⅰ与BAC两种液体的物理方法是________________________;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式: _______________________
(4)若0.1 mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电解质溶液与电离平衡练习卷(解析版) 题型:选择题
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液的pH如下表:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中正确的是( )
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HS )>c(S
)>c(S )>c(OH-)
)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电化学练习卷(解析版) 题型:选择题
下列与装置有关的说法中正确的是( )

A.图a中,随着电解的进行溶液中H+的浓度越来越大
B.图b中,Al电极作电池的负极,电极反应为Al-3e- Al3+
Al3+
C.图c中,发生的反应为Co+Cd2+ Cd+Co2+
Cd+Co2+
D.图d中:K分别与M、N连接,Fe电极均受到保护不会腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构和元素周期律练习卷(解析版) 题型:选择题
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )

A.Z、N两种元素的离子半径相比,前者较大
B.X、M两种元素的气态氢化物的稳定性相比,前者较弱
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构与性质(选修3)练习卷(解析版) 题型:填空题
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式 。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数分别为 个、 个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子、离子化学式分别为 、 (各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示。

三聚氰胺分子中氮原子轨道杂化类型是 ,1 mol三聚氰胺分子中σ键的数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com