
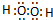 ,
,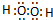 ;
;

 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
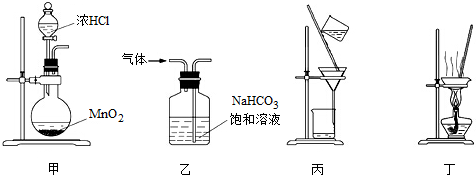
| A、用装置甲制取氯气 |
| B、用装置乙除去氯气中混有的少量氯化氢 |
| C、用装置丙分离二氧化锰和氯化锰溶液 |
| D、用装置丁蒸干氯化锰溶液制MnCl2?4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题;
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题;查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
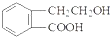 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | NH3(H2O) | 浓硫酸 | 洗气 |
| B | HNO3溶液(H2SO4) | BaCl2溶液 | 过滤 |
| C | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| D | 乙醇(水) | 生石灰 | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com