
 ,名称是环己烷
,名称是环己烷 .
. 分析 生成的白色沉淀为碳酸钙,根据C原子守恒可计算出该有机物分子中含有的C原子数;浓硫酸增重的为水的质量,根据H元素守恒可计算出该有机物分子中含有的H原子数,从而得出其分子式;
(1)若该烃不能使溴水反应或高锰酸钾溶液褪色,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则该有机物为环己烷;
(2)若该烃能使溴水褪色,该烃在催化剂作用下,与H2发生加成反应,生成2,2-二甲基丁烷,含有1个C=C双键,则该烃为(CH3)3CCH=CH2,据此解答.
解答 解:将产物通入足量澄清石灰水,得到的白色沉淀质量为30.0g,该白色沉淀为碳酸钙,根据C原子守恒可知:n(CO2)=n(CaCO3)=$\frac{30.0g}{100g/mol}$=0.3mol,则该有机物分子中含有C原子数为:N(C)=$\frac{0.3mol}{0.05mol}$=6;
用浓硫酸吸收产物,增重的5.4g为水,则水的物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol,根据H原子守恒,该有机物分子中含有H原子数为:N(H)=$\frac{0.3mol×2}{0.05mol}$=12,
所以该有机物的分子式为:C6H12,
故答案为:C6H12;
(1)若该烃不能使溴水反应或高锰酸钾溶液褪色,则其分子中不存在碳碳双键,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则该有机物为环己烷,其结构简式为: ,
,
故答案为: ;环己烷;
;环己烷;
(2)若该烃能使溴水褪色,该烃在催化剂作用下,与H2发生加成反应,生成2,2-二甲基丁烷,含有1个C=C双键,则该烃为(CH3)3CCH=CH2,名称为3,3-二甲基-1-丁烯,发生加聚反应的方程式为:n(CH3)3CCH=CH2$\stackrel{催化剂}{→}$ ,
,
故答案为:(CH3)3CCH=CH2、3,3-二甲基-1-丁烯;n(CH3)3CCH=CH2$\stackrel{催化剂}{→}$ .
.
点评 本题考查有机物分子式、结构简式的确定、烯烃的性质与命名等知识,题目难度中等,注意掌握燃烧法根据原子守恒确定有机物分子式的方法,明确常见有机物结构与性质为解答关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 推广节能灯和LED灯泡替代一般白炽灯 | |
| B. | 大力发展地铁,轻轨电车等城市公共交通 | |
| C. | 鼓励购买大排量家庭用燃油汽车 | |
| D. | 提倡使用手帕,减少纸巾的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的结构式:N≡N | B. | CH4分子的比例模型: | ||
| C. | NH3分子的电子式: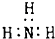 | D. | 乙醇分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
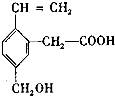 ,这种有机物不可能具有的性质是( )
,这种有机物不可能具有的性质是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 能发生酯化反应 | ||
| C. | 能跟NaOH溶液反应 | D. | 不能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①和④ | B. | 只有②和③ | C. | 只有①和③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据电解质的电离程度数据推测电解质溶液的导电性 | |
| B. | 用分子所具有能量数据分析分子的稳定性 | |
| C. | 应用固体溶解度数据判断某些复分解反应能否进行 | |
| D. | 利用电解质的电离常数判断某些酸式盐的水溶液的酸碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 其他条件相同时,增大反应物浓度,反应物中活化分子的百分数增加 | |
| C. | 焓变和熵变都与反应的自发性有关,它们都能独立地作为自发性的判据 | |
| D. | 常温下,FeCl3溶液中由水电离出的c (H+)一定大于1×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
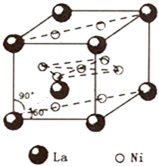 镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com