
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O,
2PbSO4+2H2O,

则下列说法正确的是:
A. 放电时:电子流动方向由A经导线流向B
B. 放电时:正极反应是Pb-2e-+SO42-PbSO4
C. 充电时:铅蓄电池的负极应与充电器电源的正极相连
D. 充电时:阳极反应是PbSO4-2e-+2H2OPbO2+SO42-+4H+
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】若用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol CH4分子所含质子数为1.6 NA
B. 在0℃,101kPa时,22.4 L H2中含有NA个氢原子
C. 16 g氧气和16 g臭氧所含的原子数均为NA
D. NA个CO分子和11.2L CH4的质量比为7:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算
(1) 1mol HCl中含有HCl分子的个数是_______________________,1.204×1023个CH4分子的物质的量是____________mol。
(2)17克NH3的物质的量是 ______ mol,0.1mol H2O的质量是______________________g。
(3)标准状况下,11.2L O2的物质的量是 ______ mol ,1mol O2的体积是 ______ L。
(4)将8g NaOH配制成1L溶液,其物质的量浓度为_______________mol/L,1L 1mol/L NaOH溶液中含有溶质NaOH的质量是______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是 ( )
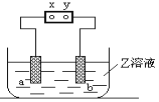
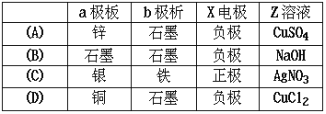
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。已知200℃时:
反应 I : 3N2H4(g)=N2(g)+4NH3(g) △Hl=-32.9kJ/mol
反应II: N2H4(g)+H2(g)=2NH3(g) △H2=-41.8 kJ/mol

下列说法不正确的是
A. 图l所示过程①、②都是放热反应
B. 反应Ⅱ的能量过程示意图如图2所示
C. 断开3 molN2H4(g)中的化学键吸收的能量大于形成1 molN2(g)和4 molNH3(g)中的化学键释放的能量
D. 200℃时,肼分解生成氨气和氢气的热化学方程式为N2H4(g) =N2(g)+2H2 (g) △H=+50.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质。下列叙述中不正确的是( )
A.油脂在酸性或碱性条件下均可以水解
B.蔗糖、淀粉、纤维素水解的最终产物都是葡萄糖
C.葡萄糖可与新制的氢氧化铜悬浊液共热反应产生砖红色沉淀
D.蛋白质的颜色反应是指浓硝酸使蛋白质变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制480 mL 0.5 mol/L NaOH溶液。
⑴ 该同学在实验过程中,用到的玻璃仪器有:量筒、玻璃棒、胶头滴管___________。
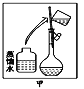
⑵ 其操作步骤如乙图所示,则甲图操作应在乙图中的____(填选项字母)之间。
A.①与② B.②与③ C.④与⑤ D.⑤与⑥
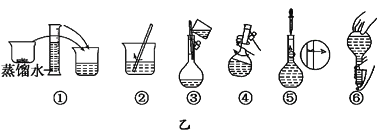
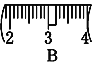
⑶ 该同学应称取NaOH固体___g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_____(填小写字母),
并在下图中选出能正确表示游码位置的选项____(填大写字母)。
附表:砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |


⑷ 该同学实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是____(填序号)。
A.称量NaOH固体时,采用了“左码右物” B.容量瓶中原来存有少量水
C.溶解固体的烧杯移液后未洗涤 D.用胶头滴管加水定容时仰视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol (NH4)2S的质量为__g。
(2)标准状况下,1.7 g NH3与__LH2S气体含有的氢原子数相同。
(3)标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量为__mol,RO2的相对分子质量为__。
(4)与0.2molH2含有相同电子数目的氦气分子的物质的量为_____。
(5)标准状况下, NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为____,该气体对氢气的相对密度为___,NH3的体积分数为____。
(6)同温同压下,等体积的CO和CO2的物质的量之比__,所含氧元素的质量比__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,易挥发,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,草酸晶体(H2C2O4 · 2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是_____,由此可知草酸晶体分解的产物中有_____,装置B的主要作用是_____。
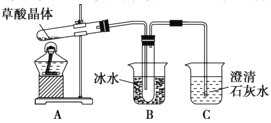
(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可重复选用)进行实验。
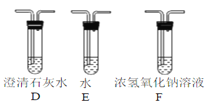

①乙组同学的实验装置中,依次连接的合理顺序为A、B、_____,装置H中装有的物质是_____。
②能证明草酸晶体分解产物中有CO的现象是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com