
����Ŀ��Ϊ̽���������ȡ����Ӧ��������ͼװ������������ʵ�飺
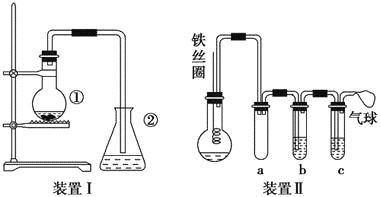
��һ�����ı����������ƿ�У�ͬʱ����������м��3��5min���ֵ���AgNO3����ƿ����dz��ɫ�ij������ɣ���֤�������巢����ȡ����Ӧ��]
��1��װ���������еĻ�ѧ����ʽΪ______________________________________��
��2��װ�����г����ܵ�������__________________________��
��3����ƿ�к�ɫ��״Һ�����л���ijɷ���________��Ҫ��õ������ĸò������_________________ϴ�ӡ�ϴ�Ӻ����ֲ�ƷӦʹ�õ�������___________________��
��4����ͬѧ�����ͼ��ʾװ��������������ijЩ�Լ���ɸ�ʵ�顣��ѡ�õ��Լ��ǣ�����Һ�壻Ũ�������������Һ����������Һ�����Ȼ�̼��
a��������__________________��b�е��Լ���___________________��
�Ƚ�����װ�ã�װ��������Ҫ�ŵ���______________________________��
���𰸡���1��2Fe��3Br2===2FeBr3��![]()
��2����������������
��3��![]() ��Br2��NaOH��Һ����Һ©����
��Br2��NaOH��Һ����Һ©����
��4����ֹ������ȫװ�ã��������Ȼ�̼����Ҫ�ŵ��ǣ�����ֹ�����������Կ��Ʒ�Ӧ���г̶ȣ����������ʸ��ţ�����ֹ��Ⱦ������
�������������������1������������Ӧ�����廯����2Fe+3Br2�T2FeBr3������Һ�����廯���Ĵ������������屽���廯�⣺![]() ���ʴ�Ϊ��2Fe+3Br2�T2FeBr3��
���ʴ�Ϊ��2Fe+3Br2�T2FeBr3��![]() ��
��
��2����ӦΪ���ȷ�Ӧ���������ûӷ��������嵥����������ֹ�Բ���ĸ��ţ��������ܵ�����Ϊ�����������������ʴ�Ϊ������������������
��3����Ӧ���ɵ��屽���廥�ܳʺ��ɫ��״Һ�Σ�����NaOH��Һ�Լ�ϴ�ӣ��÷�Ӧ��������ˮ�����ʣ��ٽ��з�Һ���ʴ�Ϊ![]() ��Br2��NaOH��Һ����ˮ������Һ©����
��Br2��NaOH��Һ����ˮ������Һ©����
��4����ͼ����Ϣ��֪��֧���Ƕ̽��̳�a�������Ƿ�ֹ������ȫװ�ã�B��Ҫ��ȥBr2���Լ�Ϊ�������Ȼ�̼����װ�õ��ŵ��ǣ����Կ��Ʒ�Ӧ���У��������ʸ��ţ���ֹ��Ⱦ�������ʴ�Ϊ����ֹ������CCl4��![]() �����Կ��Ʒ�Ӧ���У��������ʸ��ţ���ֹ��Ⱦ������
�����Կ��Ʒ�Ӧ���У��������ʸ��ţ���ֹ��Ⱦ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10��9m~10��7m��Χ�ڣ���ԭ�ӡ����ӽ��н��в��ݵ����׳����Ӽ���������ʵ�����벻���ı仯������ͭ��һ���������ͻ����ȼ�գ�����������ը������˵����ȷ����
A������ͭ��һ�����ͻ����� B������ͭ��������ͨͭ����������������Ӧ
C������ͭ����ͨͭ����ͭԭ�ӵ����ͬ D������ͭ�����ܷⱣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Ԫ�����ڱ������λ����ͼ��ʾ������Y������������������������ȡ���Ҫ��ش��������⣺
X | ||||
Y | Z | W |
��1��д��W�������ṹʾ��ͼ__________
��2���Ƚ�W ��Z������������Ӧˮ�������Ե�ǿ�� ��д��ѧʽ��
��3��д��X���⻯��ĵ���ʽ ��д��X�⻯���ˮ��Һ��X������������Ӧ��ˮ�����ˮ��Һ��Ӧ�����ӷ���ʽ
��4����֪���� C(s)+ O2(g)= CO2(g) ![]() H=a kJ�� mol-1���� CO2(g) +C(s)=2CO(g)
H=a kJ�� mol-1���� CO2(g) +C(s)=2CO(g) ![]() H=b kJ�� mol-1��
H=b kJ�� mol-1��
�� Si(s)+ O2(g)=SiO2(s) ![]() H=c kJ�� mol-1��д����ҵ��������̼�ۻ�ԭ����������ȡ�ֹ���Ȼ�ѧ��_____________________________��
H=c kJ�� mol-1��д����ҵ��������̼�ۻ�ԭ����������ȡ�ֹ���Ȼ�ѧ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�漰����ȼ�ϵ���������Ҫ�о�CO2��CO֮���ת����Ϊ��Ū������ɣ���һ������CO2������̼������ɱ���ܱ������з�Ӧ��C(s)��CO2(g)![]() 2CO(g) H�����ѹǿ���¶ȶ�CO��CO2��ƽ����ɵ�Ӱ����ͼ��ʾ��
2CO(g) H�����ѹǿ���¶ȶ�CO��CO2��ƽ����ɵ�Ӱ����ͼ��ʾ��
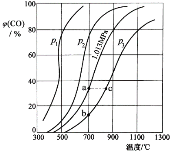
�ش��������⣺
��1��p1��p2��p3�Ĵ�С��ϵ��______________�������C��CO2��Ӧ��CO2��ƽ��ת������Ӧ��ȡ�Ĵ�ʩΪ ��ͼ��a��b��c�����Ӧ��ƽ�ⳣ����С��ϵ��____________��
��2��900 ����1.013 MPaʱ��1 mol CO2������̼��Ӧ��ƽ������������ΪV��CO2��ת����Ϊ_________���÷�Ӧ��ƽ�ⳣ��K�� ��
��3������2����ƽ����ϵ�¶Ƚ���640 ����ѹǿ����0.1013 MPa�����´ﵽƽ���CO2���������Ϊ50%�������ı�ʱ������Ӧ���淴Ӧ������α仯��_______������֮���кι�ϵ��____________________��
��4��һ�������£���CO2������̼��Ӧ����ƽ����ϵ�м���H2���ʵ������������з�Ӧ������CO(g)��3H2(g)![]() CH4(g)��H2O(g) H1��-206.2 kJ/mol
CH4(g)��H2O(g) H1��-206.2 kJ/mol
CO(g)��H2O(g)![]() CO2(g)��H2(g) H2��-41.2 kJ/mol
CO2(g)��H2(g) H2��-41.2 kJ/mol
�� �������̼��������Ӧת��Ϊ�����ˮ�������Ȼ�ѧ����ʽ��_________________��
�� ��֪298 Kʱ��ػ�ѧ����������Ϊ��
��ѧ�� | H��H | O��H | C��H |
|
E/(kJ��mol-1) | 436 | 465 | 413 | 1076 |
����ݼ��ܼ��㣬H1�� ����������ʵ��ֵ����ϴ��ԭ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����N2��H2Ϊ��Ӧ�����A��ϡ����Ϊ�������Һ�����Ƴ��̵ܹ�������ȼ�ϵ�أ�
ԭ������ͼ��ʾ������˵������ȷ���ǣ� ��
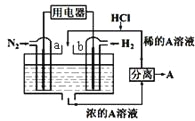
A. b�缫Ϊ����������������Ӧ
B. a�缫�����ķ�ӦΪN2+8H++6e����2NH4+
C. A��Һ����������ΪNH4Cl
D. ����Ӧ����1molN2ʱ�������ĵ�H2Ϊ67.2L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������У��������͵���������ȵ��ǣ� ��
A.Na+��He
B.H2O��D2O
C.NH4+��NH3
D.H2SO4��H3PO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˹�м�����������������Ϊ1��4ʱ���ױ�ը����ʱ�����������������Ϊ
A�� 1��4 B��1��2 C��1��1 D��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������д��ȷ����
A. 3�������� B. ������֬ C. ���� D. Ӳ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(Na2S2O3)��һ����Ҫ�Ļ�����Ʒ��������ˮ�������ֽ⣬Na2S2O3ϡ��Һ��BaCl2��Һ����������ɡ���ҵ�Ʊ�Na2S2O3�ķ�ӦΪ�� S(s)+Na2SO3(aq)![]() Na2S2O3(aq)����Ʒ������������Na2CO3 �� Na2SO3��Na2SO4��ʵ������������ʵ��װ����C���Ʊ�Na2S2O3��
Na2S2O3(aq)����Ʒ������������Na2CO3 �� Na2SO3��Na2SO4��ʵ������������ʵ��װ����C���Ʊ�Na2S2O3��
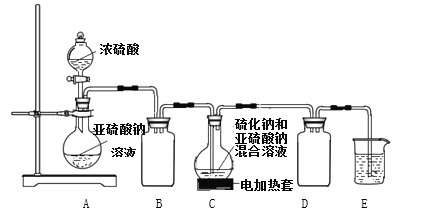
��ش��������⣺
(1)����ͼ��ʾװ�ý���ʵ�飬װ��A�з�Ӧ�Ļ�ѧ����ʽ��______________________��װ��C�пɹ۲쵽��Һ�ȱ���ǣ����ֳ��壬���ɵĻ������ʻ�ѧʽΪ___________��
(2)װ��B������Ϊ_________��Ϊ��֤Na2S2O3�IJ�����ʵ����ͨ���SO2���ܹ�����ԭ����_________��
(3)Ϊ����֤������������ƹ�ҵ��Ʒ�к���̼���ƣ�ѡ������װ�ý���ʵ�飺
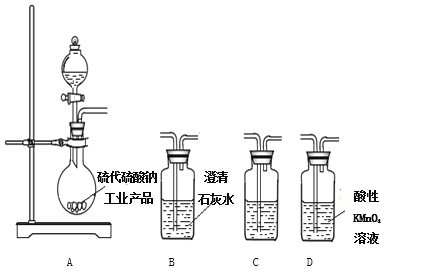
��ʵ��װ�õ�����˳������________________(��װ�õ���ĸ����)��װ��C�е��Լ�Ϊ____________��
����֤�������к���̼���Ƶ�ʵ��������__________________��
(4)��Ҫ���������������ƹ�ҵ��Ʒ�к���Na2SO3�����ȼ�ˮ���ϡ��Һ�������μ�����Լ�Ϊ_____________________��Ʒ����Һ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com