
����Ŀ��X��Y��Z��WΪ���ֳ����Ķ�����Ԫ�ء�����YԪ��ԭ�Ӻ�������������������Ӳ�����3�������������ڱ��е����λ����ͼ��ʾ��
X | Y | |
Z | W |
��ش��������⣺
��1��W�����ڱ���λ��___��
��2��X�����ܹ�����+1�������ӣ������ʽ��___��Y����̬�⻯���Z����̬�⻯��ķе�ߣ�Ե����___��
��3��X������������ˮ���������⻯���ܻ�������M��M�ľ�������Ϊ___��M��ˮ��Һ�����Ե�Ե����___(�����ӷ���ʽ��ʾ)��
��4����Y��Z�����һ����̬������Q��Q����W�ĵ����ڳ�ʪ�����з�Ӧ����Ӧ�Ļ�ѧ����ʽ��___��
����һ�������£�������Q��Y�ĵ��ʷ�Ӧ��ƽ��ʱ��������̬���ʣ���Ӧʱ��ÿת��4mol���ӷ���190.0kJ���÷�Ӧ���Ȼ�ѧ����ʽ��___��
���𰸡�����VIIA ![]() H2O���Ӽ��������� ���Ӿ��� NH4++H2O
H2O���Ӽ��������� ���Ӿ��� NH4++H2O![]() NH3��H2O+H+ SO2+Cl2+2H2O=2HCl+H2SO4 2SO2(g)+O2(g)
NH3��H2O+H+ SO2+Cl2+2H2O=2HCl+H2SO4 2SO2(g)+O2(g)![]() 2SO3(g)��H=-190.0kJ/mol
2SO3(g)��H=-190.0kJ/mol
��������
�ɶ�����Ԫ��X��Y��Z��W��Ԫ�����ڱ��е�λ�ã���֪X��Y���ڵڶ����ڣ�Z��W���ڵ������ڣ�Yԭ�ӵ�����������������Ӳ�����3��������������Ϊ6����YΪOԪ�أ�����֪XΪNԪ�ء�ZΪSԪ�ء�WΪCl��
(1)������������֪��WΪClԪ�أ��������ڱ��е������ڵ�VIIA�壬�ʴ�Ϊ������VIIA��
(2)������������֪��XΪNԪ�أ�X������Թ���+1��������ΪNH4+�������ʽ��![]() ��YΪOԪ�أ�ZΪSԪ�أ�Y����̬�⻯��H2O��Z����̬�⻯��H2S�ķе�ߣ�����ΪH2O���Ӽ������������ʴ�Ϊ��
��YΪOԪ�أ�ZΪSԪ�أ�Y����̬�⻯��H2O��Z����̬�⻯��H2S�ķе�ߣ�����ΪH2O���Ӽ������������ʴ�Ϊ��![]() ��H2O���Ӽ�����������
��H2O���Ӽ�����������
(3) ������������֪��XΪNԪ�أ�X������������ˮ�������������⻯�ﰱ���ܻ�������MΪNH4NO3���������Ӿ��壬ˮ��Һ��笠�����ˮ��NH4++H2O![]() NH3��H2O+H+���ƻ�ˮ�ĵ���ƽ�⣬��Һ�����ԣ��ʴ𰸣����Ӿ��壬NH4++H2O
NH3��H2O+H+���ƻ�ˮ�ĵ���ƽ�⣬��Һ�����ԣ��ʴ𰸣����Ӿ��壬NH4++H2O![]() NH3��H2O+H+��
NH3��H2O+H+��
(4) �� ������������֪��YΪOԪ�أ�ZΪSԪ�أ�WΪCl�� Y��Z�����һ����̬������QΪSO2��SO2���������ڳ�ʪ�����з�Ӧ����������HCl,��Ӧ�Ļ�ѧ����ʽ�ǣ� SO2+Cl2+2H2O=2HCl+H2SO4���ʴ�Ϊ��SO2+Cl2+2H2O=2HCl+H2SO4��
����һ�������£�������Q��SO2����YΪOԪ�صĵ���(O2)��Ӧ��ƽ��ʱ��������̬���ʣ���Ӧ����ʽΪ��2SO2+O2![]() 2SO3����Ӧʱ��ÿת��4mol���ӷ���190.0kJ����μӷ�Ӧ��������Ϊ2mol������Ϊ1mol������2mol SO3���ų�����Ϊ190.0kJ�����Ը÷�Ӧ���Ȼ�ѧ����ʽ��2SO2(g)+O2(g)
2SO3����Ӧʱ��ÿת��4mol���ӷ���190.0kJ����μӷ�Ӧ��������Ϊ2mol������Ϊ1mol������2mol SO3���ų�����Ϊ190.0kJ�����Ը÷�Ӧ���Ȼ�ѧ����ʽ��2SO2(g)+O2(g)![]() 2SO3(g)��H=-190.0kJ/mol���ʴ�Ϊ�� 2SO2(g)+O2(g)
2SO3(g)��H=-190.0kJ/mol���ʴ�Ϊ�� 2SO2(g)+O2(g)![]() 2SO3(g)��H=-190.0kJ/mol��
2SO3(g)��H=-190.0kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧУ��ѧ��ȤС��Ϊ̽��������������ۺ����ã�ר�����ʵ���ú�����������ͭ�ĺϽ���ȡ�������Ȼ�����Һ���̷�����(FeSO4��7H2O)�͵�������(CuSO4��5H2O)����ʵ�鷽�����£�
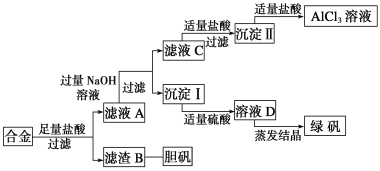
��ش��������⣺
(1)�����õIJ���������___________________________________________________��
(2)����ҺCת��Ϊ������Ĺ�������������������ƣ��ɸ�ΪͨCO2���壬д����ҺC��ͨ�����CO2�����ӷ���ʽ��______________________________________________��
д���ɳ�����ת��ΪAlCl3��Һ�����ӷ���ʽ��_____________________________��
(3)С���Ա������⣬�����Ƶõ��̷��������Է�������Ҫ������Щ���ʣ�_______________________________��Ҫ���ɳ����������Ƶô��Ƚϸߵ��̷���Ӧ��θĽ�___________________________________
(4)С���Ա�������л�֪H2O2��һ����ɫ��������������B�м���ϡ�����H2O2���Ʊ��������壬��÷�Ӧ���ܻ�ѧ����ʽΪ_______________________________��
(5)��ͬѧ����ɽ�����������ܽ�Ͻ�������Ϊ�ռ������Ʒ�����Ҳ�������Ƶ��������ʣ�����Ϊ�ڶ��ַ�������ڵ�һ�ַ���________(������������������������)��������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һ����ɫ�����ĩ����ΪNa2CO3��NaHCO3���е�һ�֣������ʵ��ȷ���ð�ɫ��ĩ�ijɷ�________________________________________��
(2)ijͬѧ����CO32-�������ô�����Һ����̪�Լ����Ȼ�����Һ�������һ��̽��������Һ�ʼ�������CO32-�������ʵ�鷽������Ҫʵ�鲽�輰ʵ������Ϊ��
�� CO32-ˮ������ӷ�Ӧ����ʽΪ____________________________________________��
�� ȡ�����Ȼ�����Һ�����̪�������ɫ��˵����_____________________________��
�� ȡ����̼������Һ�������̪���Ժ�ɫ���ټ����Ȼ�����Һ������Ϊ��____________________________��˵��_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¡����ݵ��ܱ������з�����ӦA(s)+2B(g)![]() C(g)+D(g)�����������������ٱ仯ʱ�����ܹ������÷�Ӧ�Ѵ�ƽ��״̬����
C(g)+D(g)�����������������ٱ仯ʱ�����ܹ������÷�Ӧ�Ѵ�ƽ��״̬����
A.��������ѹǿB.��������ƽ����Է�������
C.A�����ʵ���D.B�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ͼ���л����˵��������ǣ� ��

A.���л���ķ���ʽΪC8H9O4Br
B.1mol���л�����������3molH2��Ӧ
C.�ܷ���������Ӧ��ˮ�ⷴӦ��������Ӧ
D.1mol���л�����NaHCO3��Һ��Ӧʱ���������1molNaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȼ�ϵ�صĵ������ҺΪKOH��Һ�������йظõ�ص�����������ǣ� ��
A.������ӦʽΪ��O2+2H2O+4e-�T4OH
B.����һ��ʱ����Һ��KOH�����ʵ���Ũ�Ȳ���
C.�õ�ص��ܷ�ӦʽΪ��2H2+O2�T2H2O
D.���õ������9gˮʱ��ͨ����·�ĵ���Ϊ1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��ʵ��ó��Ľ�����ȷ����![]()
A.��������ȫ����ˮ���μ�ϡ���ᣬ���ְ�ɫ��������ù����д���![]()
B.����������ˮ���ٵμ������������ְ�ɫ�������������ΪHCl
C.��ij��ɫ��Һ��NaOH��Һ�����ȣ���ʪ�����ɫʯ����ֽ�����Թܿڣ�����ֽ��죬��˵��ԭ��Һ��һ����![]()
D.��ij��ɫ��Һ�еμ�NaOH��Һ��������ɫ�����������Һ�п��ܴ���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ����������������������
A.�ƹ�����̼����������������������ŷ�
B.���þ����������̫���ܵ�ؽ�̫����ֱ��ת��Ϊ����
C.���ô���ʩ��������β����CO��NOת��Ϊ������
D.�ƽ�С��������վ���˽�������ط��õ����ѣ��ٽ��ط����õĿ��ٷ�չ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʮ��������ѧ�����߶Ե��������̼�����������˹㷺������о���ȡ��һЩ��Ҫ�ɹ���
I����֪2NO��g��+O2��g�� ![]() 2NO2��g���ķ�Ӧ���̷�������
2NO2��g���ķ�Ӧ���̷�������
��һ����2NO��g�� ![]() N2O2��g�� ���죩 H1<0��v1��=k1��c2��NO�� ��v1��=k1��c��N2O2��
N2O2��g�� ���죩 H1<0��v1��=k1��c2��NO�� ��v1��=k1��c��N2O2��
�ڶ�����N2O2��g��+O2��g�� ![]() 2NO2��g�� ������ H2< 0�� v2��=k2��c��N2O2��c��O2����v2��=k2��c2��NO2��
2NO2��g�� ������ H2< 0�� v2��=k2��c��N2O2��c��O2����v2��=k2��c2��NO2��
��2NO��g��+O2��g�� ![]() 2NO2��g���ķ�Ӧ������Ҫ����______��������һ���������ڶ���������Ӧ������
2NO2��g���ķ�Ӧ������Ҫ����______��������һ���������ڶ���������Ӧ������
��һ���¶��£���Ӧ2NO��g��+O2��g�� ![]() 2NO2��g���ﵽƽ��״̬����д����k1����k1����k2����k2����ʾ��ƽ�ⳣ������ʽK=____________��
2NO2��g���ﵽƽ��״̬����д����k1����k1����k2����k2����ʾ��ƽ�ⳣ������ʽK=____________��
II������CO2��CH4�����������Ի�úϳ�������Ҫ�ɷ�ΪCO��H2�������ɼ�������������ŷţ�1����֪���������в��ַ�Ӧ���Ȼ�����ʽΪ��
�� CH4��g��=C��s��+2H2��g�� ��H>0
�� CO2��g��+H2��g��=CO��g��+H2O��g�� ��H>0
�� CO��g��+H2��g��=C��s��+H2O��g�� ��H<0
�̶�n��CO2��=n��CH4�����ı䷴Ӧ�¶ȣ�CO2��CH4��ƽ��ת���ʼ�ͼ�ס�
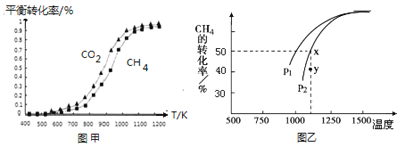
ͬ�¶���CO2��ƽ��ת����________��������������С����������������CH4��ƽ��ת���ʡ�
��2�����ܱ�������ͨ�����ʵ�����Ϊ0.1mol��CH4��CO2����һ�������·�����ӦCO2��g�� + CH4��g�� ![]() 2CO��g�� + 2H2��g����CH4��ƽ��ת�������¶ȼ�ѹǿ����λPa���Ĺ�ϵ��ͼ����ʾ��y�㣺v������_____v���棩��������������С��������������������֪�����ѹ��p����=������ѹ��p��������������ʵ�����������ƽ���ѹ����ƽ��Ũ�ȿ��Եõ�ƽ�ⳣ��Kp����x���Ӧ�¶��·�Ӧ��ƽ�ⳣ��Kp=__________________��
2CO��g�� + 2H2��g����CH4��ƽ��ת�������¶ȼ�ѹǿ����λPa���Ĺ�ϵ��ͼ����ʾ��y�㣺v������_____v���棩��������������С��������������������֪�����ѹ��p����=������ѹ��p��������������ʵ�����������ƽ���ѹ����ƽ��Ũ�ȿ��Եõ�ƽ�ⳣ��Kp����x���Ӧ�¶��·�Ӧ��ƽ�ⳣ��Kp=__________________��
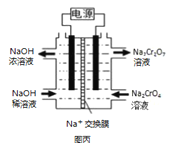
III������2CrO42��+2H+ ![]() Cr2O72��+H2O�����ͼ��װ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7��ͼ�����Ҳ�缫���ӵ�Դ��__��������Ʊ����̵��ܷ�Ӧ����ʽΪ__���ⶨ����Һ��Na��Cr�ĺ�������Na��Cr�����ʵ���֮��Ϊa��b�����ʱNa2CrO4��ת����Ϊ__����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪ__��
Cr2O72��+H2O�����ͼ��װ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7��ͼ�����Ҳ�缫���ӵ�Դ��__��������Ʊ����̵��ܷ�Ӧ����ʽΪ__���ⶨ����Һ��Na��Cr�ĺ�������Na��Cr�����ʵ���֮��Ϊa��b�����ʱNa2CrO4��ת����Ϊ__����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪ__��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com