
向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.NH4+ + SO42— + Ba2+ +OH—  BaSO4↓+ NH3·H2O
BaSO4↓+ NH3·H2O
B.2Al3+ + 3SO42— +3Ba2+ +6OH— 3BaSO4↓+ 2Al(OH)3↓
3BaSO4↓+ 2Al(OH)3↓
C.Al3+ + 2SO42— + 2Ba2+ + 4OH— 2BaSO4↓+ AlO2— + 2H2O
2BaSO4↓+ AlO2— + 2H2O
D.NH4++Al3+ +2SO42— +2Ba2+ +4OH— 2BaSO4↓+ Al(OH)3↓+ NH3·H2O
2BaSO4↓+ Al(OH)3↓+ NH3·H2O
BD
【解析】
试题分析:铵明矾[NH4Al(SO4)2?12H2O]是一种复盐,向其溶液中逐滴加入Ba(OH)2溶液,硫酸根沉淀钡离子,同时氢氧根离子沉淀铝离子,随滴入的氢氧化钡增多,硫酸根离子全部沉淀,同时铝离子沉淀完全,过量的氢氧根离子和铵根离子结合生成一水合氨,氢氧化铝不能溶解在氨水中,继续滴入氢氧化钡,氢氧化铝沉淀溶解,依据离子反应顺序书写离子方程式判断;A、反应中氢氧化钡先生成硫酸钡沉淀和氢氧化铝沉淀;故A错误;B、NH4Al(SO4)2和Ba(OH)2 按照2:3混合反应生成硫酸钡沉淀、氢氧化铝沉淀、此时硫酸根离子过量,反应的离子方程式为2Al3+ + 3SO42— +3Ba2+ +6OH— 3BaSO4↓+ 2Al(OH)3↓,B正确;C、NH4Al(SO4)2和Ba(OH)2 按照1:2恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,继续加入氢氧化钡0.5mol,氢氧化铝沉淀完全溶解,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-→2BaSO4↓+NH3?H2O+AlO2-+2H2O,C不正确;D、NH4Al(SO4)2和Ba(OH)2 按照1:2恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,反应的离子方程式为NH4++Al3+ +2SO42— +2Ba2+ +4OH—
3BaSO4↓+ 2Al(OH)3↓,B正确;C、NH4Al(SO4)2和Ba(OH)2 按照1:2恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,继续加入氢氧化钡0.5mol,氢氧化铝沉淀完全溶解,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-→2BaSO4↓+NH3?H2O+AlO2-+2H2O,C不正确;D、NH4Al(SO4)2和Ba(OH)2 按照1:2恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,反应的离子方程式为NH4++Al3+ +2SO42— +2Ba2+ +4OH— 2BaSO4↓+ Al(OH)3↓+ NH3·H2O,故D正确,答案选BD。
2BaSO4↓+ Al(OH)3↓+ NH3·H2O,故D正确,答案选BD。
考点:考查离子方程式的正误判断


科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分:
族 周期 |
|
|
| |||||
1 | ① |
|
|
|
|
|
|
|
2 |
|
|
|
|
| ② |
|
|
3 | ③ |
|
| ④ |
| ⑤ | ⑥ |
|
Ⅰ.请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)写出元素②的离子结构示意图______________。
(2)②、③、⑤的离子半径由大到小的顺序为_________________________。
(3)元素④与⑥形成化合物的电子式是_________________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
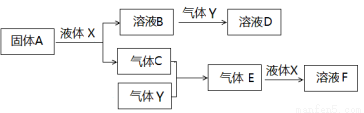
(4)写出固体A与液体X反应的离子方程式 。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D。已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,写出该条件下反应的热化学方程式 。
(7)若气体C与Y在恒容绝热的条件下反应,下列说法能判断达到平衡状态的是 。
A.温度不变 B.气体总压强不变 C.混合气体的密度不变 D.混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:填空题
大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则该溶液为 (填“酸性”或“碱性”)溶液,其原因用离子方程式解释是: 。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有
A.CaCl2溶液 B.氨水 C.Ca(OH)2悬浊液 D.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:
2NO(g) + 2CO(g)  2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。
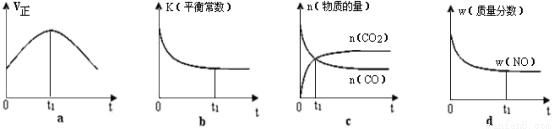
①该反应平衡常数表达式K= ;温度升高K值 (填“增大”或“减小” )
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 。
(5)使用锂离子电池为动力汽车,可减少有害气体的排放。锰酸锂离子蓄电池的反应式为:
 Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C
下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电能转化为化学能
C.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
D.充电时电池的正极应与外接电源的负极相连
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是
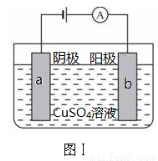
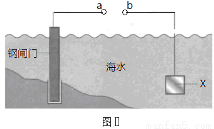
A.图Ⅰ中a为纯铜
B.图Ⅰ中SO42—向b极移动
C.图Ⅱ中如果a、b间连接电源,则a连接负极
D.图Ⅱ中如果a、b间用导线连接,则X可以是铜
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:实验题
我国化工专家侯德榜,勇于创新,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。请完成下列问题:
(1)“联合制碱法”制得的“碱”是 (填化学式)。
(2)氨碱法和联合制碱法是两大重要的工业制碱法,下列表达中,不正确的是 。
|
| 氨碱法 | 联合制碱法 |
A | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
B | 可能的副产物 | 氯化钙 | 氯化铵 |
C | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
D | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
某实验小组,利用下列装置模拟“联合制碱法”。
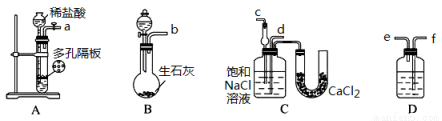
(3)取上述仪器连接装置,顺序为:(a)接( )、( )接( );(b)接( );
检验气密性后装入药品,应该先让 装置(填上述字母)先发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体。
(4)C中用球形干燥管而不用直导管,其作用是 ,D中应选用的液体为 ;
(5)C中广口瓶内产生固体的总化学方程式为 。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为: (注明你的表达式中所用的有关符号的含义)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
有 Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是
A.还原产物为NH4+
B.氧化剂与还原剂的物质的量之比为1∶8
C.若有0.5mol NO3-参加还原反应,则转移电子8mol
D.若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.35Cl、37 Cl为互为同位素,有不同的化学性质
B.氯气和二氧化硫使品红褪色的原理相同
C.浓硝酸和浓硫酸在空气中放置一段时间后浓度都会降低
D.卤化氢在空气中都能形成白雾,它们都是强电解质
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O HSO3-十OH— B.HSO3-十H2O
HSO3-十OH— B.HSO3-十H2O H2SO3十OH-
H2SO3十OH-
C.HSO3-十OH— SO32—十H2O D.H2SO3+OH-
SO32—十H2O D.H2SO3+OH- HSO3-十H2O
HSO3-十H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
反应4NH3+5O2=4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率表达正确的是
A.v(O2)=0.01mol·L-1·s-1 B.v(NO)=0.008 mol·L-1·s-1
C.v(H2O)=0.003 mol·L-1·s-1 D.v(NH3)=0.004 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com