
����Ŀ�������£���0��1000mol/L��NaOH��Һ�ζ�20mlͬŨ�ȵ�һԪ����HA���ζ�������ҺpH��X�ı仯������ͼ��ʾ�������к���ЧӦ��������˵������ȷ����

A. HA��Һ��ˮϡ�ͺ���Һ��c(HA)/c(A-)��ֵ��С
B. HA�ĵ��볣��KHA=10-7x/(100-x)��xΪ�ζ�������
C. ���ζ�����Ϊ100ʱ����Һ��ˮ�ĵ���̶����
D. �ζ���������100ʱ����Һ������Ũ�ȹ�ϵ��c��Na����>c��A-��>c��OH����>c��H����
���𰸡�D
��������
����A��HA�����ᣬ����Һ�д��ڵ���ƽ�⣺HA![]() H++A-������HA��Һ��ˮϡ�ͺ�c��A-����c��HA������ϡ�Ͷ���С�����ڵ������������Ũ�ȼ�С�ı����࣬���Ը���ƽ���ƶ�ԭ��������ƽ�������ƶ���ʹc��A-����������c��HA�����ټ�СһЩ����˴ﵽƽ��ʱ
H++A-������HA��Һ��ˮϡ�ͺ�c��A-����c��HA������ϡ�Ͷ���С�����ڵ������������Ũ�ȼ�С�ı����࣬���Ը���ƽ���ƶ�ԭ��������ƽ�������ƶ���ʹc��A-����������c��HA�����ټ�СһЩ����˴ﵽƽ��ʱ![]() ��ֵ��С����ȷ��B���������HA
��ֵ��С����ȷ��B���������HA![]() H++A-����Һ�дﵽ����ƽ��ʱ�������ʵĵ���ƽ�ⳣ����K=c��H+��c��A-��/c��HA��=10-7x/��100-x����xΪ�ζ�����������ȷ��C�����ζ�����Ϊ100ʱ���ᡢ��ǡ����ȫ��Ӧ��������NaA���������������HA��ˮ����ƽ����������ã����ټ���NaOH��Һ�������ļ�Ҳ���ˮ�ĵ���ƽ�����������ã���˵��ζ�����Ϊ100ʱ����Һ��ˮ�ĵ���̶������ȷ��D���ζ���������100ʱ����Һ������Ũ�ȹ�ϵ������c��Na����>c��A-��>c��OH����>c��H������Ҳ������c��Na����>c��OH����>c��A-��>c��H����������
H++A-����Һ�дﵽ����ƽ��ʱ�������ʵĵ���ƽ�ⳣ����K=c��H+��c��A-��/c��HA��=10-7x/��100-x����xΪ�ζ�����������ȷ��C�����ζ�����Ϊ100ʱ���ᡢ��ǡ����ȫ��Ӧ��������NaA���������������HA��ˮ����ƽ����������ã����ټ���NaOH��Һ�������ļ�Ҳ���ˮ�ĵ���ƽ�����������ã���˵��ζ�����Ϊ100ʱ����Һ��ˮ�ĵ���̶������ȷ��D���ζ���������100ʱ����Һ������Ũ�ȹ�ϵ������c��Na����>c��A-��>c��OH����>c��H������Ҳ������c��Na����>c��OH����>c��A-��>c��H����������


 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 molL1CH3COOH��Һ�д������µ���ƽ�⣺CH3COOH![]() CH3COO�� + H+�����ڸ�ƽ�⣬����������ȷ����
CH3COO�� + H+�����ڸ�ƽ�⣬����������ȷ����
A. ���ȣ�ƽ�����淴Ӧ�����ƶ�
B. ��������0.05 molL��1 H2SO4��Һ����Һ��c��H+������
C. ��������NaOH���壬ƽ��������Ӧ�����ƶ�
D. ��������ˮ��ˮ�ĵ���ƽ�ⲻ�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧѧϰС��������ͼ��ʾװ���Ʊ����ռ�Cl2��������������֤ʵ�飨�г�װ����ȥ��������˵����ȷ���ǣ� ��

A. ��![]() ��Ũ�����Ʊ�
��Ũ�����Ʊ�![]() ʱ��ֻѡ
ʱ��ֻѡ![]()
B. ![]() ����
����![]() �ռ�ʱ��aΪ������
�ռ�ʱ��aΪ������
C. ![]() �м���NaBr��Һ��
�м���NaBr��Һ��![]() ��ͨ��
��ͨ��![]() ��Ӧ�������ã��²���Һ�ʳȺ�ɫ
��Ӧ�������ã��²���Һ�ʳȺ�ɫ
D. ![]() ��ͨ��
��ͨ��![]() ʹƷ����Һ��ɫ��ȡ����Һ���ȿɻָ���ɫ
ʹƷ����Һ��ɫ��ȡ����Һ���ȿɻָ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��̬��A�ڱ�״���µ��ܶ�Ϊ1.25 g��L��1��C�ܹ�����������Ӧ�� E��B��D���ܷ���������Ӧ���й����ʵ�ת����ϵ���£�

��ش�
(1) F�Ľṹ��ʽ______��
(2) A��B�ķ�Ӧ����______��
(3) C��D�Ļ�ѧ����ʽ______��
(4) ����˵������ȷ����______��
A����������Ͷ��B�У������Ƴ���ײ����������ķų�����
B��2 mol F���Է�Ӧ����1 mol��״����������ʽΪC4H6O5
C��G����NaHCO3��Һ�л��������
D��1 mol H�����뺬2 mol NaOH��ˮ��Һ��ȫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���NaOH��Һ�����Ԫ����H2X��Һ�У������Һ�е�����Ũ������ҺpH�ı仯��ϵ����ͼ��ʾ������������ȷ���ǣ� ��

A. ����M��ʾ![]() ��pH�ı仯��ϵ
��pH�ı仯��ϵ
B. NaHX��Һ�Լ���
C. �������Һ������ʱ��![]()
D. ![]() ��������Ϊ
��������Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ�صĹ���ԭ������ͼ��ʾ��ͨ������ȼ�ϵ������ʽ(���������ҺΪ����ʱ)�ͼ�ʽ[���������ҺΪNaOH(aq)��KOH(aq)ʱ]���֡��Իش��������⣺

(1)��ʽ��صĵ缫��Ӧ��������___________________________________��������________________________________________________________������ܷ�Ӧ��________________________________________________���������ҺpH�ı仯________(��������С�����䡱)��
(2)��ʽ��صĵ缫��Ӧ��������_______________________________________��������______________________________________________________������ܷ�Ӧ��____________________________________________________���������ҺpH�ı仯________(��������С�����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������ˢ����ѧ���������ά�����ⷢ�������Ա���ۣ���Ҫ�ɷ�ΪBaCO3������SiO2��Fe2+��Mg2+�����ʣ��Ʊ����������������£�
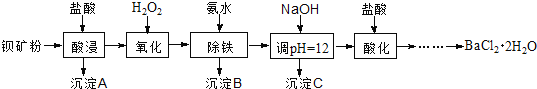
��֪��������Fe3+��Mg2+��ȫ������pH�ֱ��ǣ�3.4��12.4��
��1������A������Ϊ___________��
��2����Һ1��H2O2��Ŀ����___________��
��3����NaOH��Һ����pH��12.5���õ�����C����Ҫ�ɷ���___________��д��ѧʽ��
��4����Һ3���������ữ���پ�����Ũ��____________ϴ�ӣ���ո����һϵ�в�����õ�BaCl2��2H2O���塣
��5�������£���BaCl2��2H2O���Ƴ�0.2 mol/Lˮ��Һ��������Һ��Ӧ���ɵõ���������������д���÷�Ӧ�����ӷ���ʽ___________����֪Ksp(BaF2)��1.84��10-7������������ȫ����ʱ����������Ũ�ȡ�10-5 mol/L����������Ҫ�ķ�����Ũ����___________mol/L����֪![]() ��1.36��������������λ��Ч���֣���
��1.36��������������λ��Ч���֣���
��6��5.0 t��80��BaCO3�ı���ۣ����������������BaCl2��2H2O����___________t ��������2λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2(l)����MnO2�����º���MnO2�����·ֽ�������仯��ͼ��ʾ������˵����ȷ��

A. ��MnO2�����µķ�Ӧ������a����
B. a���߱�Ϊb���ߣ���Ӧ�Ļ���Ӱٷ�������
C. a���߱�Ϊb���ߣ�ƽ��ʱH2O2��ת��������
D. b���ߵ��Ȼ�ѧ����ʽΪ��H2O2(l) =H2O(l) +1/2O2(g) ��H= - ( E1 - E2)KJmol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ˮ����������ȷ���� �� ��
A.������ˮ��ֻ����Cl2��H2O���ַ���
B.������ˮ����ʹ��ɫʯ����ֽ�ȱ�����ɫ
C.������ˮ�������ݳ����ݳ�������������
D.��ˮ���������pH���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com