
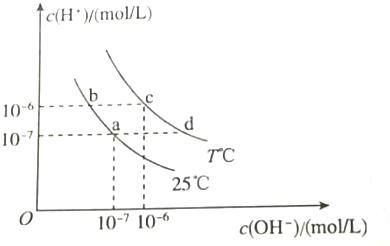
| A. | a点对应的溶液中:Al3+、Na+、Cl-、CO32- | |
| B. | b点对应的溶液中:K+、Ba2+、NO3-、AlO2- | |
| C. | c点对应的溶液中:Fe3+、Na+、I-、SO42- | |
| D. | d点对应的溶液中:Na+、K+、SO32-、Cl- |
分析 A.a点氢离子与氢氧根离子离子浓度相等,为中性溶液,铝离子与碳酸根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
B.b点为酸性溶液,偏铝酸根离子与氢离子反应;
C.c点c(H+)=c(OH-),为中性溶液,铁离子能够氧化碘离子;
D.d点溶液中c(H+)<c(OH-),四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.根据图示可知,a点溶液中c(H+)=c(OH-),Al3+、CO32-之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.b点c(H+)>c(OH-),溶液中存在大量氢离子,AlO2-与氢离子反应,在溶液中不能大量共存,故B错误;
C.c点溶液中c(H+)=c(OH-),Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.d点c(H+)<c(OH-),溶液中存在大量氢氧根离子,Na+、K+、SO32-、Cl-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;本题中根据图象曲线变化判断溶液酸碱性为解答关键.


科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| A. | X、Z、W的简单氢化物的稳定性Z>W>X | |
| B. | X元素的单质在化学反应中只表现还原性 | |
| C. | X、Y的简单离子半径Y>X | |
| D. | Y、Z、X的最高价氧化物均能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16种 | B. | 25种 | C. | 36种 | D. | 64种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质量数 | B. | 中子数 | C. | 核电荷数 | D. | 能层和能级 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
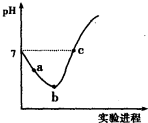
| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液:c(NH4+)大小顺序为①>②>③ | |
| B. | 0.2mol•L-1CH3COOH溶液和0.2mol•L-1CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2c(Na+) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 0.1mol•L-1NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g | B. | 6.8g | C. | 10.2g | D. | 27.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com