
| A. | 在0.1mol•L-1的Na2A溶液中,c(A2-)+c(HA-)+2c(Na+)=0.5mol•L-1 | |
| B. | 在0.1mol•L-1的H2A溶液中,c(H+)>0.12mol•L-1 | |
| C. | 将同浓度(0.1mol•L-1)的NaHA和Na2A溶液等体积混合,混合溶液可能呈碱性 | |
| D. | 0.1mol•L-1的NaHA溶液中离子浓度为c(Na+)>c(H+)>c(A2-)>c(OH-) |
分析 A.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.题中HA-?H++A2-(Ka2=1.0×10-2),电离平衡常数较大,同浓度(0.1mol•L-1)的NaHA和Na2A溶液等体积混合,其pH应小于7;
C.二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);
D.HA-只能电离不能水解,溶液呈酸性,氢氧根离子浓度较小,则c(H+)>c(A2-)>c(OH-);
解答 解:A.二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-(Ka2=1.0×10-2),可知第一步完全电离,第二步部分电离,则在0.1mol•L-1的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-)=0.1mol•L-1,又c(Na+)=0.2mol•L-1,所以c(A2-)+c(HA-)+c(Na+)=0.3mol•L-1,故A错误;
B.二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-=H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,设电离的HA-为x,则有:$\frac{(0.1+x)•x}{0.1-x}$=1.0×10-2,解得:x=0.0084.所以在0.1mol•L-1的H2A溶液中,c(H+)=0.1mol/L+0.0084mol/L=0.1084mol/L<0.12mol•L-1,故B错误;
C.由Ka2=1.0×10-2知,HA-的电离度为10%,在温度不变时,同浓度(0.1mol•L-1)的NaHA和Na2A溶液等体积混合,溶液中的c(H+)近似为0.01mol/L,变化不大,溶液仍呈酸性,溶液的pH小于7,呈酸性,故C错误;
D.0.1 mol•L-1的NaHA溶液中,HA-只能电离不能水解,则溶液呈酸性,则c(H+)>c(A2-)>c(OH-),溶液中离子浓度大小为:c(Na+))>c(HA-)>c(H+>c(A2-)>c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,正确分析电离平衡特点为解答关键,注意掌握弱电解质的电离平衡及其影响,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物对应的水化物的酸性:b<c | |
| B. | 元素的非金属性次序为:c>b>a | |
| C. | d与其他3种元素均能形成离子化合物 | |
| D. | 含d元素的化合物的焰色反应呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| T |
| A. | 元素X、W、Z在自然界中均可以游离态存在 | |
| B. | 元素X、Y、W的原子半径依次递增 | |
| C. | 实验室储存T的单质时,应在其表面覆盖少量的水 | |
| D. | 元素Z的氧化物是制作计算机芯片的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
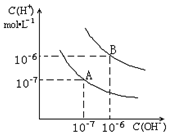 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
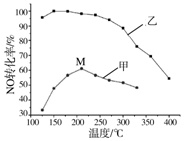 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NH4HCO3溶液和足量氢氧化钠溶液反应:NH4++OH-═NH3•H2O | |
| C. | 向FeBr2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 氯气与Na2SO3溶液反应:Cl2+SO32-+H2O═SO42-+2Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
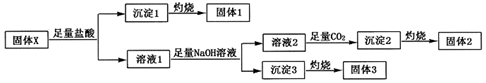
 ,沉淀2的化学式为Al(OH)3.
,沉淀2的化学式为Al(OH)3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com