
【题目】根据所学知识完成题目:
(1)某温度时,水的离子积Kw=1×10﹣13 , 则该温度25℃(填“>”、“<”或“=”).在此温度下,某溶液中由水电离出来的H+浓度为1×10﹣10 molL﹣1 , 则该溶液的pH可能为;
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和,此溶液中各种离子的浓度由大到小的排列顺序是 .
【答案】
(1)>;3或10
(2)![]() c(Na+)=c(SO
c(Na+)=c(SO ![]() )>c(H+)=c(OH﹣)
)>c(H+)=c(OH﹣)
【解析】解:(1)水的电离是吸热反应,升高温度促进水电离,氢离子和氢氧根离子浓度增大,则水的离子积常数增大,25℃时纯水中c(H+)=c(OH﹣)=10﹣7 mol/L,Kw=c(H+)c(OH﹣)=10﹣14 , 某温度(T℃)时,水的离子积常数Kw=1×10﹣13>10﹣14 , 则该温度大于25℃,溶液中由水电离出来的H+浓度为1×10﹣10 molL﹣1 , 可以是酸溶液,还可以是碱溶液,所以pH为3或10;所以答案是:>;3或10;(2)25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和,此溶液是硫酸钠的水溶液,显示中性,此时 ![]() c(Na+)=c(SO
c(Na+)=c(SO ![]() )>c(H+)=c(OH﹣),所以答案是:
)>c(H+)=c(OH﹣),所以答案是: ![]() c(Na+)=c(SO
c(Na+)=c(SO ![]() )>c(H+)=c(OH﹣).
)>c(H+)=c(OH﹣).


科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)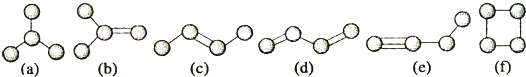
(1)写出有机物(a)的系统命名法的名称 .
(2)有机物(a)有一种同分异构体,试写出其结构简式 .
(3)上述有机物中与(c)互为同分异构体的是(填代号).
(4)任写一种与(e)互为同系物的有机物的结构简式 .
(5)上述有机物中不能与溴反应并使其褪色的有(填代号).
(6)(a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有(填代号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苄丙酮香豆素(H)常用于防治血栓栓塞性疾病,其合成路线如图所示(部分反应条件略去)。
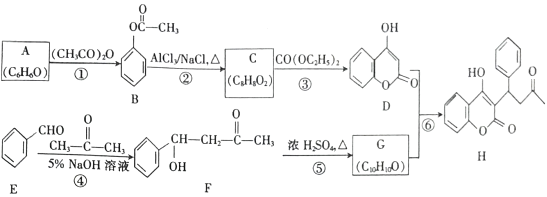
已知: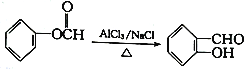
回答下列问题:
(1)A的名称是_________,H 中含氧官能团的名称是_________ 。
(2)反应①的反应类型是_________,反应④的反应类型是_________ 。
(3)C 的结构简式为_________ 。
(4)反应⑤的化学方程式为_________ 。
(5)F 的同分异构体中,满足下列条件的有_____种,其中核磁共振氢谱有7组峰,且峰面积之比为1:2:2:2:2:1:2的结构简式为__________。(任写一种)
①分子结构中除苯环外不含其他环,且不含甲基
②能和FeCl3溶液发生显色反应
③1mol该有机物能与2molNaOH 恰好完全反应
(6)参照苄丙酮香豆素的合成路线,设计一种以E和乙醛为原料(其他无机试剂任选)制备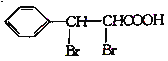 的合成路线。_____________
的合成路线。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2gCu与足量的浓硫酸在加热条件下充分反应。
(1)请写出反应的方程式_________________;
(2)若把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的BaCl2溶液,得到沉淀2.33g,则稀释后所得溶液中SO42-的物质的量浓度为_______________。
(3)若把反应后的溶液稀释至500mL,加入铁粉。最多能溶解__________g铁粉
(4)把产生的气体缓缓通入100mLamol/L的NaOH溶液中,若反应物均无剩余,则a的取值范围是___________________。
(5)若浓疏酸中含溶质bmol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的n(H2SO4)_______0.5bmol(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分 CuFeS2)制取 FeSO4·7H2O 和Cu的主要流程如下:

(1)检验酸浸过程中 Fe2+是否被氧化,应选择________(填字母编号)。
A.KMnO4 溶液 B.K3[Fe(CN)6]溶液 C.KSCN 溶液
(2)酸浸过程中主要反应的化学方程式为__________。
(3)某同学向盛有 H2O2 溶液的试管中加入几滴酸化的 FeSO4 溶液,溶液变成棕黄色,发生反应的离子方程式为___________。一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成;产生气泡的原因是_________,生成沉淀的原因是___________(用平衡移动原理解释)。
(4)已知 25℃时, Ksp[Fe(OH)3]=4.0×10-38, 此温度下,若实验室中配制 2.5mol/L 100 mLFe2(SO4)3 溶液,为使配制过程中不出现浑浊,则至少需要加10mol/L的硫酸______mL(忽略加入硫酸的体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
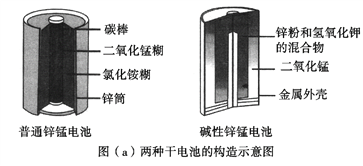
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2==Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是__________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点有_____________________。(任写一条)
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
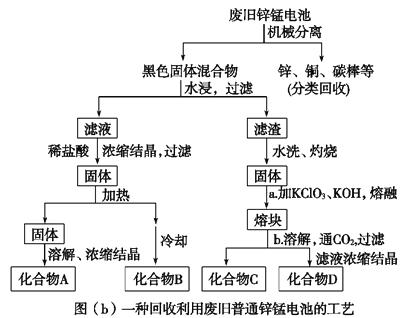
图(b)中产物的化学式分别为A_________________,B______________________。
(3)①操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液D和一种黑褐色固体C,该反应的离子方程式为_________________________。
②采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将2.0molA(g)和2.0molB(g)充入体积为1L的密闭容器中,在一定条件发生下述反应:A(g)+B(g)![]() 2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
A. t时刻反应达到平衡时,A(g)的体积分数为20%
B. T℃时该反应的化学平衡常数Kc=2
C. t时刻反应达到平衡后,缩小容器体积,平衡逆向移动
D. 相同条件下,若将1.0molA(g)和1.0molB(g)充入同样容器,达到平衡后,A(g)的转化率为50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com