
”¾ĢāÄæ”æ![]() Ź±£¬ĻČ½«Cl2»ŗĀżĶØČėĖ®ÖŠÖĮ±„ŗĶ£¬Č»ŗóĻņĖłµĆ±„ŗĶĀČĖ®ÖŠµĪ¼Ó0.1mol/LµÄKOHČÜŅŗ”£“Ė¹ż³ĢÖŠČÜŅŗpH±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ
Ź±£¬ĻČ½«Cl2»ŗĀżĶØČėĖ®ÖŠÖĮ±„ŗĶ£¬Č»ŗóĻņĖłµĆ±„ŗĶĀČĖ®ÖŠµĪ¼Ó0.1mol/LµÄKOHČÜŅŗ”£“Ė¹ż³ĢÖŠČÜŅŗpH±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ![]() ””””
””””![]()

A. ¢ŁµćµÄČÜŅŗÖŠ£ŗc(H+)=c(Cl-)+c(HClO)+c(OH-)+c(ClO-)
B. ¢ŚµćµÄČÜŅŗÖŠ£ŗc(H+)> c(Cl-)>c(ClO-)> c(HClO)
C. ¢ŪµćµÄČÜŅŗÖŠ£ŗc(K+)=c(ClO-)+c(Cl-)
D. ¢ÜµćµÄČÜŅŗÖŠ£ŗc(K+)>c(ClO-)>c(Cl-)>c(HClO)
”¾“š°ø”æC
”¾½āĪö”æ
Õūøö¹ż³Ģ·¢ÉśµÄ·“Ó¦ĪŖCl2+H2OØTHCl+HClO”¢HCl+KOHØTKCl+H2O”¢HClO+KOHØTKClO+H2O£¬øł¾ŻČÜŅŗµÄĖį¼īŠŌ½įŗĻµēŗÉŹŲŗćŗĶĪļĮĻŹŲŗć·ÖĪö½ā“š”£
A.¢ŁČÜŅŗĪŖĶØČėCl2µÄ¹ż³Ģ£¬ÓɵēŗÉŹŲŗć£ŗc(H+)=c(Cl-)+c(OH-)+c(ClO-)£¬A“ķĪó£»
B.¢ŚĪŖĶźČ«ĶØČėCl2µ½ČÜŅŗ£¬·“Ó¦“ļµ½Ę½ŗā£¬ČÜŅŗ²śÉśµČĮæµÄHClŗĶHClO£¬HClĶźČ«µēĄė£¬HClO²æ·ÖµēĄė£¬c(HClO)>c(ClO-)£¬B“ķĪó£»
C.¢ŪČÜŅŗŌŁ“Ī“ļµ½ÖŠŠŌ£¬ŅŃ¾¼ÓČėĮĖKOH²Ī¼Ó·“Ó¦£¬øł¾ŻµēŗÉŹŲŗć£ŗc(K+)+ c(H+)= c(Cl-)+ c(OH-)+c(ClO-)£¬ÓÉÓŚc£ØH+£©=c£ØOH-£©£¬ĖłŅŌÓŠ£ŗc(K+)= c(Cl-)+c(ClO-)£¬¹ŹCÕżČ·£»
D£®¢ÜČÜŅŗĪŖ¼ĢŠų¼ÓČėKOH£¬ČÜŅŗĪŖ¼īŠŌ£¬Ōņc(K+)>c(Cl-)+c(ClO-)£¬ClO-Ė®½ā£¬Ōņc(Cl-)>c(ClO-)£¬D“ķĪó£»
¹ŹŗĻĄķŃ”ĻīŹĒC”£


 Š”ѧʌĩ³å“Ģ100·ÖĻµĮŠ“š°ø
Š”ѧʌĩ³å“Ģ100·ÖĻµĮŠ“š°ø ĘŚÄ©ø“Ļ°¼ģ²āĻµĮŠ“š°ø
ĘŚÄ©ø“Ļ°¼ģ²āĻµĮŠ“š°ø ³¬ÄÜѧµäµ„ŌŖĘŚÖŠĘŚÄ©×ØĢā³å“Ģ100·ÖĻµĮŠ“š°ø
³¬ÄÜѧµäµ„ŌŖĘŚÖŠĘŚÄ©×ØĢā³å“Ģ100·ÖĻµĮŠ“š°ø »ĘøŌ360¶Č¶ØÖĘĆܾķĻµĮŠ“š°ø
»ĘøŌ360¶Č¶ØÖĘĆܾķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĪŖŹµŃéŹŅijÅØŃĪĖįŹŌ¼ĮĘæ±źĒ©ÉĻµÄÓŠ¹ŲŹż¾Ż£¬ŹŌøł¾Ż±źĒ©ÉĻµÄÓŠ¹ŲŹż¾Ż»Ų“šĻĀĮŠĪŹĢā”£

£Ø1£©øĆÅØŃĪĖįÖŠHClµÄĪļÖŹµÄĮæÅضČĪŖ__________molL©1”£
£Ø2£©Č”ÓĆČĪŅāĢå»żµÄøĆŃĪĖįŹ±£¬ĻĀĮŠĪļĄķĮæÖŠ²»ĖęĖłČ”Ģå»żµÄ¶ąÉŁ¶ų±ä»ÆµÄŹĒ_________”£
A£®ČÜŅŗÖŠHClµÄĪļÖŹµÄĮæ
B£®ČÜŅŗµÄÅضČ
C£®ČÜŅŗÖŠCl©µÄŹżÄæ
D£®ČÜŅŗµÄĆܶČ
£Ø3£©ÅäÖĘŹ±£¬ĘäÕżČ·µÄ²Ł×÷Ė³ŠņŹĒ£ØÓĆ×ÖÄø±ķŹ¾£¬Ćæøö×ÖÄøÖ»ÄÜÓĆŅ»“Ī£¬²¢ŌŚ²Ł×÷²½Öčæհד¦ĢīÉĻŹŹµ±ŅĒĘ÷Ćū³Ę£©_________”£
A£®ÓĆ30 mLĖ®Ļ“µÓ__2”«3“Ī£¬Ļ“µÓŅŗ¾ł×¢ČėČŻĮæĘ棬Õńµ“
B£®ÓĆĮæĶ²×¼Č·ĮæČ”ĖłŠčµÄÅØŃĪĖįµÄĢå»ż£¬ŃŲ²£Į§°ōµ¹ČėÉÕ±ÖŠ£¬ŌŁ¼ÓČėÉŁĮæĖ®£ØŌ¼30 mL£©£¬ÓĆ²£Į§°ōĀżĀż½Į¶Æ£¬Ź¹Ęä»ģŗĻ¾łŌČ
C£®½«ŅŃĄäČ“µÄŃĪĖįŃŲ²£Į§°ō×¢ČėČŻĮæĘæÖŠ
D£®½«ČŻĮæĘæøĒ½ō£¬Õńµ“£¬Ņ”ŌČ
E£®øÄÓĆ__¼ÓĖ®£¬Ź¹ČÜŅŗ°¼ŅŗĆęĒ”ŗĆÓėæĢ¶ČĻßĻąĒŠ
F£®¼ĢŠųĶłČŻĮæĘæÄŚŠ”ŠÄ¼ÓĖ®£¬Ö±µ½ŅŗĆę½Ó½üæĢ¶ČĻß1”«2 cm“¦
£Ø4£©ŌŚÅäÖĘ¹ż³ĢÖŠ£¬ĻĀĮŠŹµŃé²Ł×÷¶ŌĖłÅäÖʵÄĻ”ŃĪĖįµÄĪļÖŹµÄĮæÅضČÓŠŗĪÓ°Ļģ£æ£ØŌŚĄØŗÅÄŚĢīA±ķŹ¾”°Ę«“ó”±£¬ĢīB±ķŹ¾”°Ę«Š””±£¬ĢīC±ķŹ¾”°ĪŽÓ°Ļģ”±£©
a£®ÓĆĮæĶ²ĮæČ”ÅØŃĪĖįŹ±ø©ŹÓ¹Ū²ģ°¼ŅŗĆę__£»
b£®¶ØČŻŗó¾Õńµ“”¢Ņ”ŌČ”¢¾²ÖĆ£¬·¢ĻÖŅŗĆęĻĀ½µ£¬ŌŁ¼ÓŹŹĮæµÄÕōĮóĖ®_________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉč![]() ĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
ĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ![]() ””””
””””![]()
A. ±ź×¼×“æöĻĀ£¬22.4LCOŗĶCO2µÄ»ģŗĻĪļÖŠ£¬ŗ¬Ģ¼Ō×ӵďżÄæĪŖNA
B. 14g·Ö×ÓŹ½ĪŖC5H10µÄĢžÖŠ£¬ŗ¬ÓŠµÄĢ¼Ģ¼Ė«¼üµÄŹżÄæĪŖ0.2NA
C. 0.1mol/LµÄCH3COONH4ČÜŅŗÖŠ£¬ŗ¬ļ§øłĄė×ÓŹżÄæŠ”ÓŚ0.1NA
D. ±ź×¼×“æöĻĀ2.24LCl2ĶØČė×ćĮæĖ®ÖŠ»ņNaOHČÜŅŗÖŠ£¬×ŖŅʵē×ÓŹżÄæĪŖ0.1NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĖ®ŌŚ25”ęŗĶ95”ꏱ£¬ĘäµēĄėĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾£ŗ

(1)Ōņ25 ![]() Ź±Ė®µÄµēĄėĘ½ŗāĒśĻßÓ¦ĪŖ_______(Ģī”°A”±»ņ”°B”±)£¬ ĒėĖµĆ÷ĄķÓÉ____________________________________
Ź±Ė®µÄµēĄėĘ½ŗāĒśĻßÓ¦ĪŖ_______(Ģī”°A”±»ņ”°B”±)£¬ ĒėĖµĆ÷ĄķÓÉ____________________________________
(2)25![]() Ź±£¬½«pH£½9µÄNaOHČÜŅŗÓėpH£½3µÄH2SO4ČÜŅŗ»ģŗĻ£¬ČōĖłµĆ»ģŗĻČÜŅŗµÄ pH£½7£¬ŌņNaOHČÜŅŗÓėH2SO4ČÜŅŗµÄĢå»ż±ČĪŖ_________
Ź±£¬½«pH£½9µÄNaOHČÜŅŗÓėpH£½3µÄH2SO4ČÜŅŗ»ģŗĻ£¬ČōĖłµĆ»ģŗĻČÜŅŗµÄ pH£½7£¬ŌņNaOHČÜŅŗÓėH2SO4ČÜŅŗµÄĢå»ż±ČĪŖ_________
(3)95![]() Ź±£¬Čō100Ģå»ż pH1£½a µÄijĒæĖįČÜŅŗÓė10Ģå»ż pH2£½bµÄijĒæ¼īČÜŅŗ»ģŗĻŗóČÜŅŗ³ŹÖŠŠŌ£¬Ōņ»ģŗĻĒ°£¬øĆĒæĖįµÄ pH1ÓėĒæ¼īµÄ pH2Ö®¼äÓ¦Āś×ćµÄ¹ŲĻµŹĒ__________________
Ź±£¬Čō100Ģå»ż pH1£½a µÄijĒæĖįČÜŅŗÓė10Ģå»ż pH2£½bµÄijĒæ¼īČÜŅŗ»ģŗĻŗóČÜŅŗ³ŹÖŠŠŌ£¬Ōņ»ģŗĻĒ°£¬øĆĒæĖįµÄ pH1ÓėĒæ¼īµÄ pH2Ö®¼äÓ¦Āś×ćµÄ¹ŲĻµŹĒ__________________
(4)ĒśĻßB¶ŌÓ¦ĪĀ¶ČĻĀ£¬pH£½2µÄijHAČÜŅŗŗĶpH£½10µÄNaOHČÜŅŗµČĢå»ż»ģŗĻŗ󣬻ģŗĻČÜŅŗµÄpH£½5”£Ēė·ÖĪöĘäŌŅņ£ŗ____________________________________________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĪļÖŹÖŠ£¬Ėłŗ¬·Ö×ÓŹżŅ»¶ØĻąĶ¬µÄŹĒ£Ø £©
A. 1gH2Óė8gO2
B. 0.1mol HClÓė22.4LHe
C. 18LH2OÓė18LCO2
D. 28gCOÓė1molCO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĖłŹ¾£¬¼×”¢ŅŅ”¢±ū”¢¶”ĖÄøöÉÕ±ÖŠ·Ö±šŹ¢ÓŠ100mLÕōĮóĖ®£¬Č»ŗó·Ö±š·ÅČėµČĪļÖŹµÄĮæµÄNa”¢Na2O”¢Na2O2”¢NaOH£¬“ż¹ĢĢåĶźČ«Čܽā£¬ŌņĖÄøöÉÕ±ÖŠČÜŅŗµÄÖŹĮæ·ÖŹżµÄ“óŠ”Ė³ŠņĪŖ£Ø £©
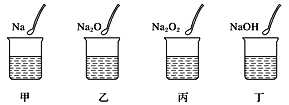
A.¼×<ŅŅ<±ū<¶”B.¶”<¼×<ŅŅ£½±ūC.¼×£½¶”<ŅŅ£½±ūD.¶”<¼×<ŅŅ<±ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¢ń:ÓĆ50mL0.50mol/LŃĪĖįÓė50mL0.55mol/LNaOHČÜŅŗŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦”£Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮææɼĘĖćÖŠŗĶČČ”£»Ų“šĻĀĮŠĪŹĢā£ŗ

(1)“ÓŹµŃé×°ÖĆÉĻæ“£¬Ķ¼ÖŠÉŠČ±ÉŁµÄŅ»ÖÖ²£Į§ÓĆĘ·ŹĒ_____________”£
(2)Čē¹ū°“Ķ¼ÖŠĖłŹ¾µÄ×°ÖĆ½ųŠŠŹŌŃ飬ĒóµĆµÄÖŠŗĶČČŹżÖµ_______(Ģī”°Ę«“ó”¢Ę«Š””¢ĪŽÓ°Ļģ”±)”£
(3)ŹµŃéÖŠøÄÓĆ60 mL 0.50 mol”¤L-1ŃĪĖįøś50 mL 0.55 mol”¤L-1NaOHČÜŅŗ½ųŠŠ·“Ó¦£¬Óė(2)ÖŠŹµŃéĻą±Č£¬ĖłĒóÖŠŗĶČČ_________ (Ģī”°ĻąµČ”±»ņ”°²»ĻąµČ”±)”£
¢ņ: (1)±±¾©°ĀŌĖ»į”°ĻéŌĘ”±»š¾ęČ¼ĮĻŹĒ±ūĶé(C3H8)£¬ŃĒĢŲĄ¼“ó°ĀŌĖ»į»š¾ęČ¼ĮĻŹĒ±ūĻ©(C3H6),±ūĶéĶŃĒāæɵƱūĻ©”£ŅŃÖŖ£ŗC3H8(g) === CH4(g)£«HC”ŌCH(g)£«H2(g) ”÷H1=+156.6 kJ”¤mol£1
CH3CH£½CH2(g)=== CH4(g)£« HC”ŌCH(g ) ”÷H2=+32.4 kJ”¤mol£1
ŌņC3H8(g) === CH3CH£½CH2(g)£«H2(g) ”÷H =______________ kJ”¤mol£1”£
(2)·¢É仚¼żŹ±ÓĆėĀ(N2H4)×÷Č¼ĮĻ£¬¶žŃõ»ÆµŖ×÷Ńõ»Æ¼Į£¬Į½Õß·“Ӧɜ³ÉµŖĘųŗĶĘųĢ¬Ė®”£ŅŃÖŖ32gN2H4(g)ĶźČ«·¢ÉśÉĻŹö·“Ó¦·Å³ö568kJµÄČČĮ棬ČČ»Æѧ·½³ĢŹ½ŹĒ£ŗ____________________________________ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°ŃVLŗ¬ÓŠMgSO4ŗĶK2SO4µÄ»ģŗĻČÜŅŗ·Ö³ÉĮ½µČ·Ż£¬Ņ»·Ż¼ÓČėŗ¬amolNaOHµÄČÜŅŗ£¬Ē”ŗĆŹ¹Ć¾Ąė×ÓĶźČ«³ĮµķĪŖĒāŃõ»ÆĆ¾£»ĮķŅ»·Ż¼ÓČėŗ¬bmolBaCl2µÄČÜŅŗ£¬Ē”ŗĆŹ¹ĮņĖįøłĄė×ÓĶźČ«³ĮµķĪŖĮņĖį±µ”£ŌņŌ»ģŗĻČÜŅŗÖŠ¼ŲĄė×ÓµÄĪļÖŹµÄĮæĪŖ
A. (b-a)molB. (2b-a)molC. 2(b-a)molD. 2(2b-a)mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©6.02”Į1023øöĒāŃõøłĄė×ÓµÄĪļÖŹµÄĮæŹĒ________mol£¬ĘäĦ¶ūÖŹĮæĪŖ________”£
£Ø2£©ŌŚ±ź×¼×“æöĻĀ£¬0.01 molijĘųĢåµÄÖŹĮæĪŖ0.44 g£¬ŌņøĆĘųĢåµÄĆܶČĪŖ________g”¤L1£Ø±£ĮōŠ”ŹżµćŗóĮ½Ī»£©£¬øĆĘųĢåµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ________”£
£Ø3£©ŌŚ±ź×¼×“æöĻĀ£¬ÓÉCOŗĶCO2×é³ÉµÄ»ģŗĻĘųĢåĪŖ6.72 L£¬ÖŹĮæĪŖ12 g£¬“Ė»ģŗĻĪļÖŠCOŗĶCO2ĪļÖŹµÄĮæÖ®±ČŹĒ________£¬COµÄĢå»ż·ÖŹżŹĒ________£¬COµÄÖŹĮæ·ÖŹżŹĒ________£¬CŗĶOŌ×ÓøöŹż±ČŹĒ________£¬»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæŹĒ________£¬ĆܶȏĒ________g”¤L1”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com