
| A. | CH3CH2CH2CH2Cl | B. | CH3CH2Cl | C. | CH3Br | D. | 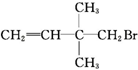 |
分析 由选项可知,均为卤代烃,均可发生水解反应,与-X相连C的邻位C上有H可发生消去反应,以此来解答.
解答 解:A.CH3CH2CH2CH2Cl可水解CH3CH2CH2CH2OH,发生消去反应生成CH3CH2CH=CH2,故A不选;
B.CH3CH2Cl可发生水解反应生成CH3CH2OH,发生消去反应生成CH2=CH2,故B不选;
C.CH3Br没有邻位C,不能发生消去反应,CH3Br水解生成CH3OH,故C选;
D. 没有邻位C,不能发生消去反应,可发生水解反应生成醇,故D选;
没有邻位C,不能发生消去反应,可发生水解反应生成醇,故D选;
故选CD.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,把握有机物的官能团的性质为解答该题的关键,题目难度不大,注意卤代烃消去反应的结构特点.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
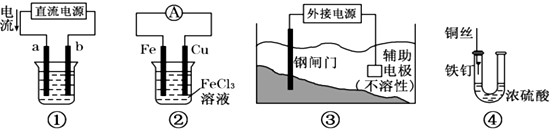
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
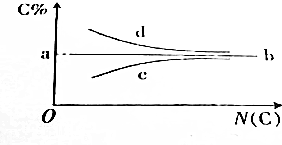
| A. | a点的值肯定是85.7% | B. | 满足b线走势的烃通式为CnH2n | ||
| C. | 满足c线走势的烃一定是烷烃 | D. | 满足d线走势的烃一定是炔烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
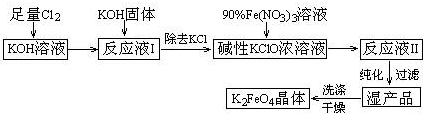
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
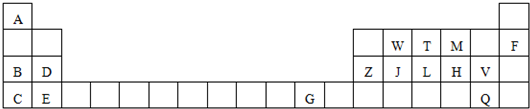
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
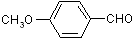 )具有多种同分异构体.
)具有多种同分异构体.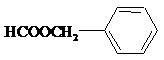 ;②
;②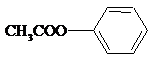 ;③
;③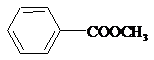 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com