
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
分析 可逆反应达到平衡时,平衡常数K越大,说明平衡体系中生成物所占的比例越大,它的正向反应进行的程度越大,K只受温度影响;
(I)H2(g)+I2(g)═2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)═H2(g)+I2(g)的平衡常数K2=1K1;
(Ⅱ)(1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动,而升高温度平衡向吸热反应移动;反应前后气体体积不变,当增大压强时,平衡不移动;
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.
解答 解:可逆反应达到平衡时,平衡常数K越大,说明平衡体系中生成物所占的比例越大,它的正向反应进行的程度越大,K只受温度影响,
故答案为:生成物;正;温度;
(I)H2(g)+I2(g)═2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)═H2(g)+I2(g)的平衡常数K2=1K1=149,故答案为:149;
(Ⅱ)(1)CO2(g)+H2(g)═CO(g)+H2O(g)的化学平衡常数K=c(CO)×c(H2O)c(CO2)×c(H2),
故答案为:c(CO)×c(H2O)c(CO2)×c(H2);
(2)由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动,而升高温度平衡向吸热反应移动;反应前后气体体积不变,当增大压强时,平衡不移动,
故答案为:吸热;不;
(3)A.反应前后气体物质的量不变,恒温恒容下,容器中压强始终不变,故A错误;
B.到达平衡时各组分浓度保持不变,混合气体中c(CO)不变,说明反应到达平衡,故B正确;
C.V(H2)正=V(H2O)逆 说明氢气的生成速率与消耗速率相等,反应到达平衡,故C正确;
D.平衡时CO2、CO浓度关系与二氧化碳转化率有关,平衡时不一定相等,故D错误,
故选:BC.
点评 本题考查化学平衡常数、化学平衡影响因素、化学平衡状态判断等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;元素C的原子组成符号是2713Al.
;元素C的原子组成符号是2713Al.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3和Al3+ | B. | Al(OH)3 | ||
| C. | Al3+、Al(OH)3 和AlO2- | D. | 全部为AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 121.6 g | B. | 93.6 g | C. | 89.6 g | D. | 88.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶实验前用蒸馏水洗干净,但未烘干 | |
| B. | 定容观察液面时俯视 | |
| C. | 用量筒量取一定量液体时,俯视液面读数 | |
| D. | 加蒸馏水时不慎超过了刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 | |
| C. | 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-=Fe3+,继而形成铁锈 | |
| D. | 将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

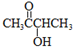 .
. CH3COO-+NH4++2Ag↓+3NH3+H2O.
CH3COO-+NH4++2Ag↓+3NH3+H2O. .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com