
| A. | NaCl晶体、BaSO4 | B. | 铝、二氧化硫 | ||
| C. | 液态的醋酸、酒精 | D. | 熔融的KNO3、硫酸溶液 |
分析 水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;水溶液中和熔融状态下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质;大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质.
解答 解:A、氯化钠晶体属于电解质,硫酸钡也是电解质,故A错误;
B、铝为单质,既不是电解质,也不是非电解质,故B错误;
C、液态醋酸为电解质,酒精为非电解质,故C正确;
D、熔融硝酸钾为电解质,而硫酸溶液为混合物,既不是电解质也不是非电解质,故D错误;
故选C.
点评 本题考查了电解质与非电解质的判断,题目难度不大,注意掌握电解质与非电解质的判断方法,单质和混合物既不是电解质,也不是非电解质.


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解Fe3O4固体的离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S+2H2O | |
| C. | 氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O | |
| D. | 向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++4OH-═${AlO}_{2}^{-}$+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
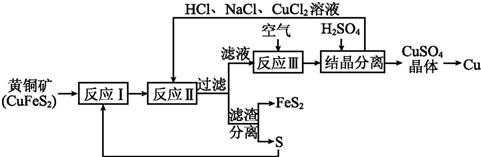
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
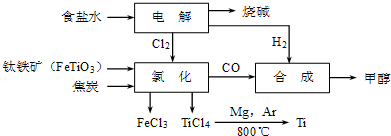
 TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
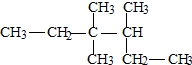
| A. | 3,4,4-三甲基己烷 | B. | 3,3-二甲基-2-乙基戊烷 | ||
| C. | 3,3,4-三甲基己烷 | D. | 3,3-二甲基-4-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
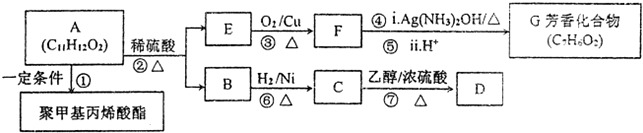
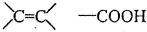 ;检验其宫能团所用化学试剂有溴的四氯化碳(或酸性高锰酸钾溶液)、碳酸氢钠溶液(或石蕊试剂).
;检验其宫能团所用化学试剂有溴的四氯化碳(或酸性高锰酸钾溶液)、碳酸氢钠溶液(或石蕊试剂). .
. (CH3)2CHCOOCH2CH3+H2O.
(CH3)2CHCOOCH2CH3+H2O.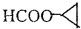 .
.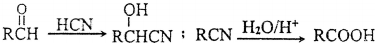
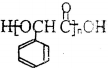 ,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂.
,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com