
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol•L-1H2C2O4溶液 | 30 mL 0.01 mol•L-1kMnO4溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4溶液 | 30 mL 0.01 mol•L-1KMnO4溶液 |

分析 (1)草酸是二元弱酸,在水溶液中不能完全电离,且分步电离;
(2)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大;
(3)先求出反应的(MnO4-)的物质的量,再求出反应后消耗高锰酸根离子的浓度,最后根据v=$\frac{△c}{△t}$计算反应速率;
(4)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率;
(5)催化剂、升高温度都能加快化学反应的速率.
解答 解:(1)草酸是二元弱酸,在水溶液中不能完全电离,且分步电离以第一步电离为主,电离方程式为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,
故答案为:H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-;
(2)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,
故答案为:浓度;<;
(3)CO2的物质的量是:$\frac{0.896L}{22.4L/mol}$=0.04mol,设2min末反应消耗的n(MnO4-)为x,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
x 0.04mol
解得:x=0.08mol,
v(MnO4-)=$\frac{\frac{0.08mol}{0.5L}}{2min}$=0.08mol/(L•min),
故答案为:0.0056;
(4)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,
故答案为:产生相同体积CO2所需要的时间(或KmnO4溶液完全褪色的时间);
(5)催化剂能加快化学反应的速率,产物Mn2+(或MnSO4)是反应的催化剂,此外反应释放热量,也可以使化学反应速率加快,
故答案为:反应放热.
点评 本题考查了影响化学反应速率的因素,难度不大,注意可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 都是红褐色 | B. | 都不能透过半透膜 | ||
| C. | 分散质的粒子都能通过滤纸 | D. | 都能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
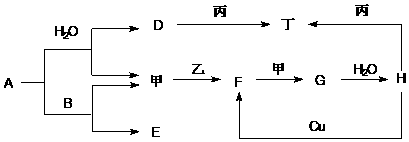
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色加深 | |
| B. | 使用铁作催化剂,使N2和H2在一定条件下合成为NH3 | |
| C. | 可用排饱和食盐水法收集氯气 | |
| D. | 500℃时比室温更有利于合成氨的反应(已知合成氨的反应时放热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$\stackrel{O_{2}催化剂}{→}$NO$\stackrel{O_{1}和H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 制取Mg:海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{高温}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据物质能否导电,可以将化合物分为电解质和非电解质 | |
| B. | 根据氧化物中是否含有金属元素,可以将氧化物分为碱性氧化物和酸性氧化物 | |
| C. | 根据组成元素的种类,将纯净物分为单质和化合物 | |
| D. | 根据分散系的稳定性大小,可以将分散系分为胶体、浊液和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
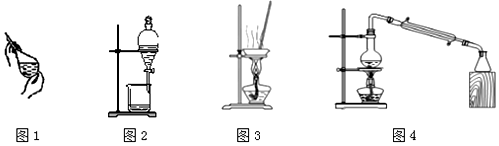
| A. | 萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的 | |
| B. | 加热胆矾晶体使其失去结晶水,用图3装置 | |
| C. | 分离CCl4和I2的混合液,如图1和图2操作 | |
| D. | 蒸馏海水得到淡水,用图4装置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com