
 Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.
Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.| 1 |
| 8 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
- 13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
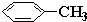
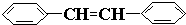
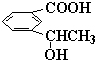

查看答案和解析>>
科目:高中化学 来源: 题型:
在短周期主族元素中
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是________(填元素名称)。
(2)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的L层上有5个电子。甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于____________晶体,其化学式为_______________,合成这种物质必需的反应条件是 。
(3)把去除了表面氧化膜的铝条浸入硝酸汞溶液,片刻后取出,放置一段时间后,可看到铝条表面生成白色毛状物,生成该物质的化学方程式为_______________________________。美国化学家发现铝的“原子群”(如Al13、Al14、Al37)各具有与某种元素相似的化学性质,并符合元素周期律的某些规律。例如:Al13与卤素具有相似的化学性质, Al13-离子具有惰性气体元素的性质,可推测Al14的化学性质与 族元素相似。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10 分)(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的P亚层上有3个电子。
①写出甲元素的电子排布式________________________;
②甲、乙元素的第一电离能关系为甲 乙(填>、<、=);两元素可形成硬度大于金刚石的一种化合物,该化合物属于______晶体,其化学式为_____________,若使其熔化,需破坏的作用关系为___________________.
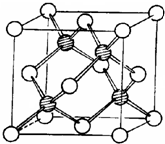
(2)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物,其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示:图中左右两边对称,各含一个近似为立方体的结构,每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一个化学键。
①请在图中左边立方体的○中填写出(在○涂黑)其余3个Fe原子
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com