

 ,电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d46s2.
,电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d46s2.分析 由流程可知,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,根据化合价升降法配平方程式;
钨酸锰和氢氧化钠反应生成钨酸钠和氢氧化锰,水浸时,氧化铁和氢氧化锰不溶于水,钨酸钠溶于水,故过滤后得到的滤液含钨酸钠,故A为钨酸钠,钨酸钠和浓盐酸反应生成钨酸和氯化钠;钨酸酸性很弱,难溶于水,判断B为钨酸;钨酸加热分解产生三氧化钨和水,判断C为三氧化钨.
(1)根据核外电子数及电子排布规律分析;
(2)根据氧化铁和氧化锰不溶于水,钨酸钠易溶于水判断A为钨酸钠,则MnWO4与NaOH反应生成二氧化锰和钨酸钠;
(3)Na2WO4与浓盐酸反应生成氯化钠和H2WO4;分离溶液和不溶性固体采用过滤方法;洗涤沉淀防止杂质混入产品中;检验沉淀是否洗净应取最后一次洗液,因沉淀中可能含氯离子,用硝酸银和稀硝酸来检验;
(4)碳或氢气都可置换出钨,但碳为固体,难以分离;
(5)把五价和六价两种价态的氧化物的化学式分别写成WO2.5和WO3,设蓝色氧化钨的组成为xWO2.5•yWO3,利用W和O的个数之比为1:2.95来解答.
解答 解:由流程可知,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,根据化合价升降法配平方程式;
钨酸锰和氢氧化钠反应生成钨酸钠和氢氧化锰,水浸时,氧化铁和氢氧化锰不溶于水,钨酸钠溶于水,故过滤后得到的滤液含钨酸钠,故A为钨酸钠,钨酸钠和浓盐酸反应生成钨酸和氯化钠;钨酸酸性很弱,难溶于水,判断B为钨酸;钨酸加热分解产生三氧化钨和水,判断C为三氧化钨.
(1)钨是74号元素,与铬(Cr)同族,钨的最外层有两个电子,核外各电子层电子数为2、8、18、32、14、2,电子层数等于周期序数,所以在周期表的位置是第六周期,其外围电子排布为5d46s2,位于第VIB族,最高正价为+6价,其原子结构示意图为 ;其电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d46s2,
;其电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d46s2,
故答案为:第六周期第VIB族;+6; ;1s22s22p63s23p63d104s24p64d104f145s25p65d46s2;
;1s22s22p63s23p63d104s24p64d104f145s25p65d46s2;
(2)氧化铁和氧化锰不溶于水,钨酸钠易溶于水判断A为钨酸钠,则MnWO4与NaOH反应生成二氧化锰和钨酸钠,反应中锰元素化合价升高作还原剂,氧气作氧化剂,其反应方程式为:2MnWO4+4NaOH+O2$\frac{\underline{\;熔融\;}}{\;}$2Na2WO4+2MnO2+2H2O,
故答案为:2MnWO4+4NaOH+O2$\frac{\underline{\;熔融\;}}{\;}$2Na2WO4+2MnO2+2H2O;
(3)Na2WO4与浓盐酸反应生成氯化钠和H2WO4,其化学方程式为:Na2WO4+2HCl═H2WO4↓+2NaCl;分离溶液和不溶性固体采用过滤方法;洗涤沉淀防止杂质混入产品中,所以沉淀B必须洗涤干净的原因是防止NaCl混入生成的H2WO4中使产品不纯;检验沉淀是否洗净应取最后一次洗液,检验是否含氯离子,用硝酸银和稀硝酸来检验;
故答案为:Na2WO4+2HCl═H2WO4↓+2NaCl;过滤;防止NaCl混入生成的H2WO4中使产品不纯;取最后一次洗液,加入硝酸酸化后再加入硝酸银溶液;
(4)碳或氢气都可置换出钨,如果用碳作还原剂,混杂在金属中的碳不易除去,而且碳在高温下和金属钨也能生成碳化钨,不容易获得纯净的金属钨.H2作还原剂,过量的H2会从体系中自动逸出,
故答案为:使用H2作还原剂不易引入杂质;
(5)把五价和六价两种价态的氧化物的化学式分别写成WO2.5和WO3,设蓝色氧化钨的组成为xWO2.5•yWO3,
因W和O的个数之比为1:2.95,则有$\frac{x+y}{2.5x+3y}$=$\frac{1}{2.95}$,解得$\frac{x}{y}$=$\frac{1}{9}$;所以蓝色氧化钨中五价和六价两种价态的钨的原子数之比为1:9;
故答案为:1:9.
点评 本题主要考查工业制备流程、金属的冶炼、氧化还原反应和化学计算,并考查学生正确书写化学方程式的能力,一道综合知识的考查题,考查学生分析和解决问题的能力,综合性强,难度中等.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在水溶液或熔融状态下能导电的物质 | |
| B. | 氧化钠溶于水能电离生成钠离子和氢氧根离子,尽管氧化钠是化合物,其水溶液能导电,但溶液中的氢氧根离子并非氧化钠本身电离,因而氧化钠是非电解质 | |
| C. | 凡在水中能生成离子而导电的物质 | |
| D. | 在水溶液里或熔融状态下本身能电离出离子而导电的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡溶液混合:H++$S{{O}_{4}}^{2-}$+Ba2++OH-═BaSO4↓+H2O | |
| B. | 向明矾中滴加少量Ba(OH)2溶液:2Al3++3S${{O}_{4}}^{2-}$+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Fe(OH)3胶体的制备:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═$N{{H}_{4}}^{+}$+HS${{O}_{3}}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
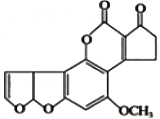 目前,我国有不法商贩用地沟油牟取暴利.医学研究证明,地沟油中的黄曲霉素强烈致癌.已知一种黄曲霉素的结构简式如图所示,关于该分子的说法中正确的是
目前,我国有不法商贩用地沟油牟取暴利.医学研究证明,地沟油中的黄曲霉素强烈致癌.已知一种黄曲霉素的结构简式如图所示,关于该分子的说法中正确的是| A. | 1个分子中共含有30个δ键 | B. | 有5个碳原子采用sp3杂化 | ||
| C. | 属于极性分子,易溶于水 | D. | 分子中所有原子都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2的催化氧化是工业上生产硫酸的关键步骤.
SO2的催化氧化是工业上生产硫酸的关键步骤.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于1nm | B. | 在1~100nm间 | C. | 大于100nm | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaH溶于水,得到的水溶液能导电,由此可说明NaH是离子化合物 | |
| B. | Fe(OH)3胶体和Fe(OH)3沉淀的物理性质不同但化学性质基本相同 | |
| C. | CO2、SO2、SiO2、NO2等都是酸性氧化物;Na2O、MgO、A2lO3等都是碱性氧化物 | |
| D. | MnO2具有较强氧化性,可作为H2O2分解反应的氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com