
”¾ĢāÄæ”æA(C2H4)ŗĶ E(C3H4)ŹĒ»ł±¾µÄÓŠ»ś»Æ¹¤ŌĮĻ”£ÓÉ A ŗĶ E Öʱø¾Ūõ£ŃĒ°·ÅŻÄĖÜĮĻ(PMI)µÄŗĻ³ÉĀ·ĻßČēĻĀ:(²æ·Ö·“Ó¦Ģõ¼žĀŌČ„)

ŅŃÖŖ£ŗ¢ŁRCH= CH2![]() RCH2CH2CHO
RCH2CH2CHO
¢ŚR1CHO+R2CH2CHO![]() (×¢:R1 æÉŅŌŹĒĢž»ł,Ņ²æÉŅŌŹĒ H Ō×Ó)
(×¢:R1 æÉŅŌŹĒĢž»ł,Ņ²æÉŅŌŹĒ H Ō×Ó)
¢ŪF µÄŗĖ“Ź²ÕńĒāĘ×ÓŠĮ½ÖÖ»Æѧ»·¾³µÄĒā£¬Ęä·åĆ껿֮±ČĪŖ 2”Ć3 »Ų“šĻĀĮŠĪŹĢā£ŗ
(1)B ŗ¬ÓŠµÄ¹ŁÄÜĶÅĆū³ĘŹĒ____________£» ¢ŽµÄ·“Ó¦ĄąŠĶŹĒ____________ £»
(2)C ÓėŠĀÖĘ Cu(OH)2 ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_____________________________________£»
(3)ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ____________”£
A£®A(C2H4)ŗĶ E(C3H4)ÕāĮ½ÖÖ»ł±¾µÄÓŠ»ś»Æ¹¤ŌĮĻæÉĶعżŹÆÓĶĮŃ½ā»ńµĆ
B£®1molF ×ī¶ąæÉÓė 3molH2 ·¢Éś¼Ó³É·“Ó¦
C£®PMI ŌŚ¼īŠŌĢõ¼žĻĀ¼ÓČČÄÜ·¢ÉśĖ®½ā·“Ó¦ÓŠ“Ģ¼¤ŠŌĘųĪ¶µÄĘųĢå²śÉś
D£®A”¢B”¢C”¢D”¢E”¢F ĮłÖÖĪļÖŹ¾łÄÜŹ¹äåĖ®ĶŹÉ«
”¾“š°ø”æČ©»ł ¼Ó³É·“Ó¦ CH2=C(CH3)CHO+2Cu(OH)2+NaOH”śCu2O”ż+ CH2=C(CH3)COONa+3H2O BCD
”¾½āĪö”æ
ÓÉ·Ö×ÓŹ½æÉÖŖAĪŖCH2=CH2£¬ÓÉŠÅĻ¢¢ŁæÉÖŖBĪŖCH3CH2CHO£¬BÓėHCHO·¢ÉśŠÅĻ¢¢ŚÖŠµÄ·“Ӧɜ³ÉC£¬½įŗĻCµÄ·Ö×ÓŹ½æÉÖŖ£¬CµÄ½į¹¹¼ņŹ½ĪŖCH2=C£ØCH3£©CHO£¬C·¢Éś“ß»ÆŃõ»ÆÉś³ÉDĪŖCH2=C£ØCH3£©COOH£¬FµÄŗĖ“Ź²ÕńĒāĘ×ÓŠĮ½ÖÖ»Æѧ»·¾³µÄĒā£¬Ęä·åĆ껿֮±ČĪŖ2£ŗ3£¬½įŗĻ·“Ó¦¢ŻµÄ²śĪļ½į¹¹æÉÖŖFĪŖCH2=C£ØCH3£©CN£¬EĪŖCH”ŌCCH3£¬¾Ż“Ė·ÖĪö½ā“š”£
ÓÉ·Ö×ÓŹ½æÉÖŖAĪŖCH2=CH2£¬ÓÉŠÅĻ¢¢ŁæÉÖŖBĪŖCH3CH2CHO£¬BÓėHCHO·¢ÉśŠÅĻ¢¢ŚÖŠµÄ·“Ӧɜ³ÉC£¬½įŗĻCµÄ·Ö×ÓŹ½æÉÖŖ£¬CµÄ½į¹¹¼ņŹ½ĪŖCH2=C£ØCH3£©CHO£¬C·¢Éś“ß»ÆŃõ»ÆÉś³ÉDĪŖCH2=C£ØCH3£©COOH£¬FµÄŗĖ“Ź²ÕńĒāĘ×ÓŠĮ½ÖÖ»Æѧ»·¾³µÄĒā£¬Ęä·åĆ껿֮±ČĪŖ2£ŗ3£¬½įŗĻ·“Ó¦¢ŻµÄ²śĪļ½į¹¹æÉÖŖFĪŖCH2=C£ØCH3£©CN£¬EĪŖCH”ŌCCH3”£
(1) BĪŖCH3CH2CHO£¬ŗ¬ÓŠµÄ¹ŁÄÜĶÅĆū³ĘŹĒČ©»ł£» ¢ŽŹĒ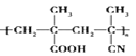 ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś·“Ӧɜ³É
ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś·“Ӧɜ³É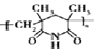 £¬øł¾ŻĮ½ÕߵĽį¹¹¼ņŹ½æÉÖŖ£¬·“Ó¦ĄąŠĶŹĒ¼Ó³É·“Ó¦£»
£¬øł¾ŻĮ½ÕߵĽį¹¹¼ņŹ½æÉÖŖ£¬·“Ó¦ĄąŠĶŹĒ¼Ó³É·“Ó¦£»
(2)C ĪŖCH2=C£ØCH3£©CHO£¬ÓėŠĀÖĘ Cu(OH)2 ·“Ӧɜ³ÉשŗģÉ«³Įµķ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖCH2=C(CH3)CHO+2Cu(OH)2+NaOH”śCu2O”ż+ CH2=C(CH3)COONa+3H2O£»
(3)A£®ŹÆÓĶĮŃ½āÖ÷ŅŖæɵƵ½ŅŅĻ©”¢±ūĻ©”¢¶”¶žĻ©µČ²»±„ŗĶĢžµČ£¬¹ŹA(C2H4)æÉĶعżŹÆÓĶĮŃ½ā»ńµĆ£¬ E(C3H4)²»ÄÜ£¬Ń”ĻīA“ķĪó£»
B£®FÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼üŗĶ-CN£¬1molF ×ī¶ąæÉÓė 3molH2 ·¢Éś¼Ó³É·“Ӧɜ³ÉCH3CH£ØCH3£©CH2NH2£¬Ń”ĻīBÕżČ·£»
C£®PMI ŌŚ¼īŠŌĢõ¼žĻĀ¼ÓČČÄÜ·¢ÉśĖ®½ā·“Ó¦ÓŠ“Ģ¼¤ŠŌĘųĪ¶µÄĘųĢå°±Ęų²śÉś£¬Ń”ĻīCÕżČ·£»
D£®A”¢B”¢C”¢D”¢E”¢F ĮłÖÖĪļÖŹÖŠA”¢C”¢D”¢Fŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬B”¢Cŗ¬ÓŠČ©»ł£¬Eŗ¬ÓŠĢ¼Ģ¼Čż¼ü£¬¾łÄÜŹ¹äåĖ®ĶŹÉ«£¬Ń”ĻīDÕżČ·”£
“š°øŃ”BCD”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©ĻĀĮŠ±ä»ÆŅ»¶Ø¼ÓČė»¹Ō¼Į²ÅÄÜŹµĻֵďĒ______________£ØĢīŠņŗÅ£©
¢ŁFe2+”śFe ¢ŚCO2”śHCO3-¢Ū MnO4-”śMn2+ ¢ÜSO2”śSO3 ¢ŻKMnO4”śMnO2 ¢Ž HCl”śCl2 ¢ßSO32-”śSO2 ¢ąNH4+”śNH3
£Ø2£©ĪŅ¹ś¹Å“śĖÄ“ó·¢Ć÷Ö®Ņ»µÄŗŚ»šŅ©ŹĒÓÉĮņ·Ū”¢ĻõĖį¼ŲŗĶľĢæ°“Ņ»¶Ø±ČĄż»ģŗĻ¶ų³É£¬±¬ÕØŹ±µÄ·“Ó¦ĪŖS+ 2KNO3 +3C = K2S + N2”ü + 3CO2”ü£¬·“Ó¦ÖŠ±»»¹ŌµÄĪļÖŹŹĒ ___________£ØĢī»ÆѧŹ½£©
£Ø3£©NaHæÉŌŚŅ°Ķā×÷ÉśĒā¼Į£¬·“Ó¦ŌĄķĪŖNaH + H2O = NaOH + H2”ü£¬øĆ·“Ó¦ÖŠŃõ»Æ²śĪļŗĶ»¹Ō²śĪļµÄÖŹĮæ±ČĪŖ____________ ”£
£Ø4£©2KMnO4 + 16HCl£ØÅØ£© = 2KCl + 2MnCl2 +5Cl2”ü + 8H2O£¬ÓƵ„ĻßĒűź³öµē×Ó×ŖŅʵķ½ĻņŗĶŹżÄæ__________£»HCl±ķĻÖ³öµÄŠŌÖŹŹĒ ___________________”£
£Ø5£©Č”300mL 0.2mol”¤ L-1µÄKIČÜŅŗÓėŅ»¶ØĮæµÄĖįŠŌKMnO4ČÜŅŗĒ”ŗĆ·“Ó¦£¬Éś³ÉµČĪļÖŹµÄĮæµÄI2ŗĶKIO3£¬ŌņĻūŗÄKMnO4µÄĪļÖŹµÄĮæŹĒ _________mol”£
£Ø6£©ĪŖĮĖ¼ģŃéijŗ¬ÓŠNaHCO3ŌÓÖŹµÄNa2CO3ѳʷµÄ“æ¶Č£¬ĻÖ½«w1gѳʷ¼ÓČČ£¬ĘäÖŹĮæ±äĪŖw2 g£¬ŌņøĆѳʷµÄ“æ¶Č£ØÖŹĮæ·ÖŹż£©ŹĒ______________ £ØÓĆŗ¬w1ŗĶw2µÄŹ½×Ó±ķŹ¾£©”£
£Ø7£©Č”50mLŗ¬Na2CO3ŗĶNa2SO4µÄ»ģŗĻČÜŅŗÓė¹żĮæŃĪĖį·“Ó¦£¬Éś³É2.24L CO2£Ø±ź×¼×“æö£©£¬Č»ŗó¼ÓČė×ćĮæµÄBa£ØOH£©2ČÜŅŗ£¬µĆµ½µÄ³ĮµķµÄÖŹĮæĪŖ2.33g”£ŹŌ¼ĘĖćŌ»ģŗĻČÜŅŗÖŠNa+µÄĪļÖŹµÄĮæÅضČ______ mol/L”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÅŠ¶Ļŗ¬ŃõĖįĒæČõµÄŅ»Ģõ¾Ńé¹ęĀÉ£ŗŗ¬ŃõĖį·Ö×Ó½į¹¹ÖŠŗ¬·ĒōĒ»łŃõŌ×ÓŹżŌ½¶ą£¬øĆŗ¬ŃõĖįµÄĖįŠŌŌ½Ē攣¼øÖÖŹµĄżČēĻĀ±ķĖłŹ¾”£

(1)ŃĒĮ×Ėį(H3PO3)ŗĶŃĒÉéĖį(H3AsO3)µÄ·Ö×ÓŹ½ĻąĖĘ£¬µ«ĖüĆĒµÄĖįŠŌ²ī±šŗÜ“ó”£ŃĒĮ×ĖįŹĒÖŠĒæĖį£¬ŃĒÉéĖį¼ČÓŠČõĖįŠŌÓÖÓŠČõ¼īŠŌ£¬ÓÉ“ĖæÉĶĘ³öĖüĆĒµÄ½į¹¹Ź½·Ö±šĪŖ£ŗŃĒĮ×Ėį_________£¬ŃĒÉéĖį________”£
(2)ŃĒĮ×ĖįŗĶŃĒÉéĖįÓė¹żĮæµÄNaOHČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½·Ö±šŹĒ£ŗŃĒĮ×Ėį£ŗ_____£¬ŃĒÉéĖį£ŗ______”£
(3)ŌŚŃĒĮ×ĖįŗĶŃĒÉéĖįÖŠ·Ö±š¼ÓČėÅØŃĪĖį£¬·ÖĪö·“Ó¦Ēéæö£¬Š“³ö»Æѧ·½³ĢŹ½________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŠ”×éÄāÉč¼ĘĪ¢ÉśĪļČ¼ĮĻµē³Ų½«ĪŪĖ®ÖŠµÄŅŅ¶ž°·[H2N(CH2)2NH2]Ńõ»Æ³É»·¾³ÓŃŗƵÄĪļÖŹ£¬¹¤×÷ŌĄķČēĶ¼ĖłŹ¾(a”¢b¾łĪŖŹÆÄ«µē¼«£©”£ĻĀĮŠ·ÖĪöÕżČ·µÄŹĒ)

A. µē×ÓĮ÷¶Æ·½ĻņĪŖa”śµ¼Ļß”śb
B. H+¾ÖŹ×Ó½»»»Ä¤ÓÉÓŅĻņ×óŅʶÆ
C. ·ÅµēŅ»¶ĪŹ±¼äb¼«ø½½üpH²»±ä
D. aµē¼«·¢Éś·“Ó¦£ŗH2N(CH2)2NH2+16e-+4H2O==2CO2”ü+N2”ü+16H+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·“Ó¦¢ŁCO(g)£«CuO(s)![]() CO2(g)£«Cu(s)ŗĶ·“Ó¦¢ŚH2(g)£«CuO(s)
CO2(g)£«Cu(s)ŗĶ·“Ó¦¢ŚH2(g)£«CuO(s)![]() Cu(s)£«H2O(g)ŌŚĻąĶ¬µÄijĪĀ¶ČĻĀµÄĘ½ŗā³£Źż·Ö±šĪŖK1ŗĶK2£¬øĆĪĀ¶ČĻĀ·“Ó¦¢ŪCO(g)£«H2O(g)
Cu(s)£«H2O(g)ŌŚĻąĶ¬µÄijĪĀ¶ČĻĀµÄĘ½ŗā³£Źż·Ö±šĪŖK1ŗĶK2£¬øĆĪĀ¶ČĻĀ·“Ó¦¢ŪCO(g)£«H2O(g)![]() CO2(g)£«H2(g)µÄĘ½ŗā³£ŹżĪŖK”£ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
CO2(g)£«H2(g)µÄĘ½ŗā³£ŹżĪŖK”£ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
A. ·“Ó¦¢ŁµÄĘ½ŗā³£ŹżK1£½c(CO2).c(Cu)/c(CO).c(CuO)
B. ·“Ó¦¢ŪµÄĘ½ŗā³£ŹżK£½K1/K2
C. ¶ŌÓŚ·“Ó¦¢Ū£¬ŗćČŻŹ±£¬ĪĀ¶ČÉżøߣ¬H2ÅØ¶Č¼õŠ”£¬ŌņøĆ·“Ó¦µÄģŹ±äĪŖÕżÖµ
D. ¶ŌÓŚ·“Ó¦¢Ū£¬ŗćĪĀŗćČŻĻĀ£¬Ōö“óŃ¹Ē棬H2ÅضČŅ»¶Ø¼õŠ”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠČ¼ÉÕ·“Ó¦µÄ·“Ó¦ČČŹĒČ¼ÉÕČȵďĒ(””””)
A. H2(g)£«![]() O2(g)===H2O(g)¦¤H1 B. C(s)£«O2(g)===CO(g)¦¤H2
O2(g)===H2O(g)¦¤H1 B. C(s)£«O2(g)===CO(g)¦¤H2
C. S(s)£«O2(g)===SO2(g)¦¤H3 D. H2S(g)£«![]() O2(g)===S(s)£«H2O(l)¦¤H4
O2(g)===S(s)£«H2O(l)¦¤H4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ25”ꏱ£¬CH3COONH4ČÜŅŗ³ŹÖŠŠŌ£®
¢ń£®½«0.1molL©1µÄCH3COOHČÜŅŗÓė0.1molL©1µÄNaOHČÜŅŗµČĢå»ż»ģŗĻ£Ø»ģŗĻČÜŅŗµÄĢå»ż±ä»ÆŗöĀŌ²»¼Ę£©£¬²āµĆ»ģŗĻČÜŅŗµÄpH=9£®»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾»ģŗĻČÜŅŗµÄpH=9µÄŌŅņ__£®
£Ø2£©»ģŗĻŗóČÜŅŗÖŠc£ØCH3COOH£©=__molL©1£ØĢīŠ“¾«Č·Öµ£©£®
£Ø3£©ĻąĶ¬ĪĀ¶ČĻąĶ¬ÅØ¶ČµÄĻĀĮŠĖÄÖÖČÜŅŗ£ŗ¢Ł£ØNH4£©2CO3 ¢ŚCH3COONH4 ¢Ū£ØNH4£©2SO4 ¢ÜNH4Cl£¬pHÓɓ󵽊”µÄÅÅĮŠĖ³ŠņĪŖ__£ØĢīŠņŗÅ£©£®
¢ņ£®Mg£ØOH£©2³ĮµķæÉČܽāÓŚNH4ClČÜŅŗ£®Ķ¬Ń§¶ŌÓŠ¹ŲøĆ·“Ó¦µÄŌĄķµÄ½āŹĶČēĻĀ£ŗ¼×Ķ¬Ń§ČĻĪŖŹĒNH4ClĖ®½ā£¬ČÜŅŗ³ŹĖįŠŌ£¬H+ÖŠŗĶĮĖMg£ØOH£©2µēĄė³öµÄOH©µ¼ÖĀ³ĮµķČܽā£»ŅŅĶ¬Ń§ČĻĪŖŹĒNH4+ÓėMg£ØOH£©2µēĄė³öµÄOH©·“Ӧɜ³ÉČõµē½āÖŹNH3”¤H2O£¬µ¼ÖĀ³ĮµķČܽā£®
£Ø4£©±ūĶ¬Ń§²»ÄÜæĻ¶ØÄÄĪ»Ķ¬Ń§µÄ½āŹĶŗĻĄķ£¬ÓŚŹĒŃ”ÓĆĻĀĮŠŅ»ÖÖŹŌ¼ĮĄ“ŃéÖ¤¼×”¢ŅŅĮ½Ķ¬Ń§µÄ¹Ūµć£¬ĖūŃ”ÓƵďŌ¼ĮŹĒ__
A£®NH4NO3 B£®CH3COONH4C£®Na2CO3 D£®NH3”¤H2O
£Ø5£©±ūĶ¬Ń§Ń”ŌńøĆŹŌ¼ĮµÄĄķÓÉŹĒ£ŗ__£®
£Ø6£©±ūĶ¬Ń§½«ĖłŃ”ŹŌ¼ĮµĪ¼Óµ½Mg£ØOH£©2Šü×ĒŅŗÖŠ£¬Mg£ØOH£©2Čܽā£¬ÓÉ“ĖæÉÖŖ£ŗ__£ØĢī”°¼×”±»ņ”°ŅŅ”±£©µÄ½āŹĶøüŗĻĄķ£®Mg£ØOH£©2³ĮµķÓėNH4ClČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ__£®
£Ø7£©ĻÖÓŠMg£ØOH£©2ŗĶAl£ØOH£©3³ĮµķµÄ»ģŗĻĪļ£¬Čō³żČ„Mg£ØOH£©2µĆµ½“æ¾»µÄAl£ØOH£©3£¬æÉÓĆ__£ØĢīŠ“ĖłÓĆŹŌ¼ĮµÄ»ÆѧŹ½£¬ŹŌ¼Į“Ó±¾ĢāÉę¼°µÄŹŌ¼Į֊єȔ£¬ĻĀĶ¬£©£»Čō³żČ„Al£ØOH£©3µĆµ½“æ¾»µÄMg£ØOH£©2£¬æÉÓĆ_______________________________________£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒāĘųŹĒŅ»ÖÖŹ®·ÖŹģĻ¤µÄĪļÖŹ£¬ŌŚŠķ¶ą·“Ó¦ÖŠ¼ČæÉ×÷ĪŖ·“Ó¦Īļ£¬Ņ²æÉ×÷ĪŖÉś³ÉĪļ”£
£Ø1£©µē½ā±„ŗĶŹ³ŃĪĖ®æÉÖĘČ”ĒāĘų£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½____”£
£Ø2£©ŌŚĒāĘų»¹ŌŃõ»ÆĶµÄ·“Ó¦ÖŠ£¬±ź³öµē×Ó×ŖŅʵķ½Ļņ¼°ŹżÄ攣____
H2+CuO![]() Cu+H2O
Cu+H2O
£Ø3£©ŌŚĶŠæŌµē³ŲÖŠ£¬ČēĶ¼£¬ŌŚĶ¼«ø½½ü擵½µÄĻÖĻóŹĒ____£»µē×ÓĮ÷Ļņ“Ó___”£

£Ø4£©ĒāĘų×÷ĪŖČ¼ĮĻ£¬ÓŠ1gĒāĘųČ¼ÉÕÉś³ÉŅŗĢ¬Ė®·Å³ö142.8kJČČĮ棬±ķŹ¾øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½_____”£
£Ø5£©ŹµŃéŹŅÓĆŠæÓėĻ”ĮņĖį·“Ó¦ÖĘČ”ĒāĘų£¬Ä³Ń§Š£ŹµŃéŌ±ĪŖĮĖĢįøßÖĘĒāµÄĖŁ¶Č£¬ŌŚ“ĖČÜŅŗÖŠ¼ÓČėÉŁĮæĮņĖįĶČÜŅŗ£¬ÄćČĻĪŖŗĻĄķĀš£æĪŖŹ²Ć“£æ____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚ¾§ĢåĖµ·ØµÄÕżČ·×éŗĻŹĒ””””””

¢Ł·Ö×Ó¾§ĢåÖŠ¶¼“ęŌŚ¹²¼Ū¼ü””
¢ŚŌŚ¾§ĢåÖŠÖ»ŅŖÓŠŃōĄė×Ó¾ĶŅ»¶ØÓŠŅõĄė×Ó””
¢Ū½šøÕŹÆ”¢SiC”¢NaF”¢NaCl”¢H2O”¢H2S¾§ĢåµÄČŪµćŅĄ“Ī½µµĶ””
¢ÜĄė×Ó¾§ĢåÖŠÖ»ÓŠĄė×Ó¼üƻӊ¹²¼Ū¼ü£¬·Ö×Ó¾§ĢåÖŠæĻ¶ØƻӊĄė×Ó¼ü””
¢ŻCaTiO3¾§ĢåÖŠ(¾§°ū½į¹¹ČēÉĻĶ¼ĖłŹ¾)ĆæøöTi4£«ŗĶ12øöO2£½ōĮŚ””
¢ŽSiO2¾§ĢåÖŠĆæøö¹čŌ×ÓÓėĮ½øöŃõŌ×ÓŅŌ¹²¼Ū¼üĻą½įŗĻ””
¢ß¾§ĢåÖŠ·Ö×Ó¼ä×÷ÓĆĮ¦Ō½“󣬷Ö×ÓŌ½ĪČ¶Ø””
¢ąĀČ»ÆÄĘČŪ»ÆŹ±Ąė×Ó¼ü±»ĘĘ»µ
A£®¢Ł¢Ś¢Ū¢Ž”””””””” ””””B£®¢Ł¢Ś¢Ü
C£®¢Ū¢Ż¢ß D£®¢Ū¢Ż¢ą
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com