
若a、b、c、d均大于零,下列能正确表示燃烧热的热化学方程式为
A.CH3CH2OH(l) + 3O2 (g) = 2CO2 (g) + 3H2O(l) ΔH =-a kJ/mol
B.CH4 (g) + 2O2 (g) = 2H2O(g) + CO2 (g) ΔH =-b kJ/mol
C.H2
(g) + O2 (g) = H2O(l)
ΔH = c kJ/mol
O2 (g) = H2O(l)
ΔH = c kJ/mol
D.2CH≡CH(g) + 5O2(g) =4CO2 (g) + 2H2O(l) ΔH =-d kJ/mol
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ 2NH3
2NH3 2NH3
2NH3

| 4(m-n) |
| 5 |
| 4(m-n) |
| 5 |
| 4n+m |
| 5 |
| 4n+m |
| 5 |
| 4m+3n |
| 5 |
| 4m+3n |
| 5 |
| m-3n |
| 5 |
| m-3n |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
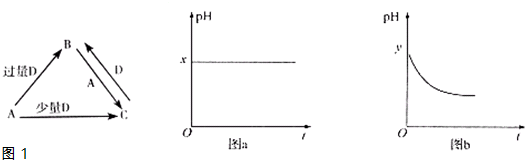
查看答案和解析>>
科目:高中化学 来源: 题型:
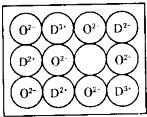 【化学-选修物质结构与性质】
【化学-选修物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com