C
分析:A、Na
2O
2是离子晶体,由Na
+离子和O
2-离子构成,每个Na
2O
2分子含有两个Na
+离子、一个O
2-离子,Na
2O
2与O
2-离子物质的量相等;
B、根据反应Cl
2+2NaOH═NaCl+NaClO+H
2O,可知,Cl
2含有的Cl原子有一半化合价从0价升高到+1价,另一半由0价降低到-1价,每摩尔Cl
2转移1mol电子;
C、氢气是双原子分子,氦是单原子分子,每个氢分子与氦分子都含两个质子,分子数相同则含有的质子数相同;
D、气体摩尔体积v
m=22.4L/mol使用范围是单一气体或能共存的混合气体(标准状况下).
解答:A、7.8gNa
2O
2的物质的量为n(Na
2O
2)=
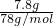
=0.1mol,含有阴离子数目为N(O
2-)=0.1mol×
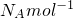
=N
A,故A错误;
B、2.24L(标准状况)Cl
2与足量NaOH溶液在常温下反应,转移的电子数为N(电子)=
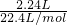
×1×
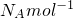
=N
A,故B错误;
C、氢气是双原子分子,氦是单原子分子,每个氢分子与氦分子都含两个质子,分子数相同则含有的质子数相同,故C正确;
D、标准状况下,SO
3是固体,不能使用气体摩尔体积v
m=22.4L/mol,2.24LSO
3的物质的量不是0.1mol,含有分子数不是0.1N
A,故D错误.
故选C.
点评:注意:标准状况下,SO
3是固体;Na
2O
2是含有的阴离子是O
2-离子,是易错点、盲点.

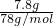 =0.1mol,含有阴离子数目为N(O2-)=0.1mol×
=0.1mol,含有阴离子数目为N(O2-)=0.1mol×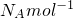 =NA,故A错误;
=NA,故A错误;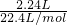 ×1×
×1×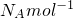 =NA,故B错误;
=NA,故B错误;
